Amminoacidi con catene di diversa lunghezza e sequenze differenti possono formare dimeri e polimeri. A seconda del numero di residui amminoacidici presenti sulla catena polimerica, i polimeri si dividono in peptidi e proteine. I peptidi contengono nella loro struttura circa 50 amminoacidi, mentre le proteine contengono in una o più catene un numero di residui amminoacidici superiore a quello dei peptidi. Sia gli amminoacidi, sia le proteine che i peptidi svolgono un ruolo importante nel corretto funzionamento dell'organismo. Grazie alle moderne terapie peptidiche è possibile favorire la rigenerazione dell'organismo.
Parole chiave: peptide · amminoacido · proteina · elica α · struttura β · catena non polare ·alanina·valina·leucina·isoleucina·fenilalanina·triptofano·metionina·prolina·glicina·serina·treonina·tirosina· cisteina·asparagina·glutammina·acido aspartico·acido glutammico·configurazione·conformazione·dipeptide ·oligopeptide·legame peptidico·ormone della crescita
Elenco delle abbreviazioni: ACTH- adrenocorticotropina; CRH- corticoliberina; POMC- proopiomelanocortina; MMC- complesso motorio migrante; GRPP- polipeptide pancreatico dipendente da glicentina; HGH- ormone della crescita Il ruolo biologico degli amminoacidi, delle proteine e dei peptidi nel corretto funzionamento e rigenerazione dell'organismo, presentato nel modo seguente, permetterà di familiarizzare con la loro azione e le possibilità che offrono.
Caratteristiche degli amminoacidi
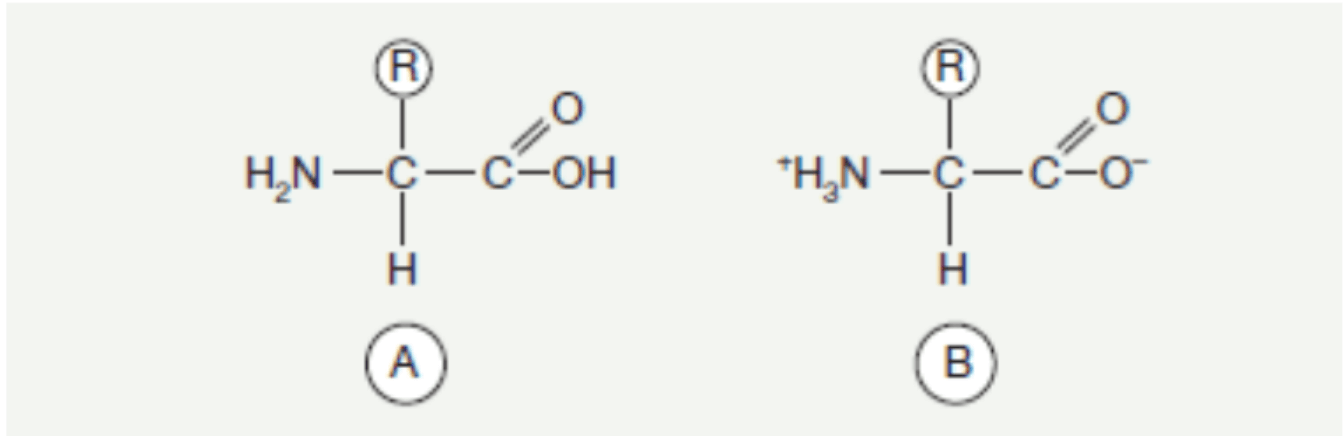
Gli amminoacidi, come uno dei componenti meglio conosciuti degli organismi viventi, si presentano come derivati di acidi organici, in cui almeno uno degli atomi di idrogeno è sostituito da un gruppo amminico. Sono componenti comunemente presenti sia in forma libera che legata - nel caso di peptidi o proteine. Ognuno degli amminoacidi presenti nelle proteine, ad eccezione della prolina e dell'idrossiprolina, possiede un gruppo amminico situato sul carbonio α e una catena laterale R, che può avere una struttura diversa ed è collegata allo stesso atomo di carbonio.
Formula generale dell'amminoacido.
A. Nella forma libera
B. Nella forma di ione zwitterionico. Nell'ambiente sono noti circa 300 amminoacidi, tuttavia quelli comunemente presenti sono 22, di cui 2 aggiuntivi sono stati scoperti relativamente di recente e si trovano solo in alcune proteine. La presenza e la posizione nella struttura della proteina degli amminoacidi già conosciuti sono determinate dalle proprietà genetiche; in alcuni casi ciò è il risultato di modifiche post-traduzionali delle residui amminoacidici, che sono stati precedentemente incorporati nella catena proteica. Gli altri amminoacidi possono esistere in forma libera o in composti non proteici. Il ruolo di un amminoacido nella proteina è determinato dalla struttura della sua catena laterale, per cui la classificazione degli amminoacidi è definita in diversi gruppi, a seconda della natura delle catene laterali possedute dall'amminoacido.
Amminoacidi con catene non polari
Al gruppo degli amminoacidi con catene non polari appartengono rispettivamente: alanina, valina, leucina, isoleucina, fenilalanina, triptofano, metionina, prolina e glicina. Nel caso degli ultimi due amminoacidi menzionati, esiste una certa relazione. La prolina, come esempio atipico, non possiede un gruppo α-amminico ma un gruppo imino, che è incorporato nella struttura dell'anello pirrolidinico. Il ruolo biologico degli amminoacidi, delle proteine e dei peptidi nel corretto funzionamento e rigenerazione dell'organismo La glicina, invece, non possiede una catena laterale, sostituita da un atomo di idrogeno. Ognuno degli amminoacidi elencati possiede una catena laterale non polare, che non ha la capacità di acquisire o perdere protoni e non partecipa alla formazione di legami idrogeno o ionici. La catena laterale è più spesso considerata lipofila, cioè idrofoba, non legante acqua. Tali catene evitano l'ambiente acquoso aderendo tra loro e sono rivolte verso l'interno della molecola proteica. Quando si trovano in un ambiente acquoso, il loro comportamento è meglio paragonabile a quello di gocce d'olio, che si uniscono in gocce più grandi, riducendo così il contatto con l'acqua.
Aminoacidi con catene laterali polari prive di carica
Al gruppo degli aminoacidi con catene laterali polari prive di carica appartengono: serina, treonina, tirosina, cisteina, asparagina e glutamina. Gli aminoacidi presentati hanno carica zero in ambiente a pH neutro, tuttavia nel caso di cisteina e tirosina, a pH basico, possono perdere un protone. Serina, treonina e tirosina sono capaci di formare legami a idrogeno grazie al gruppo idrossilico polare. Anche nel caso delle catene laterali di asparagina e glutamina possono formarsi legami a idrogeno grazie ai gruppi carbonilico e ammidico. Il gruppo ammidico dell'asparagina così come i gruppi idrossilici di serina e treonina possono essere siti di legame per componenti zuccherini. Il ruolo biologico degli aminoacidi, delle proteine e dei peptidi nel corretto funzionamento e rigenerazione dell'organismo.
Aminoacidi con catene acide
Al gruppo degli aminoacidi con catene acide appartengono l'acido aspartico e l'acido glutammico. Nella struttura delle catene laterali di questi aminoacidi sono visibili gruppi carbossilici. In ambiente a pH neutro subiscono una dissociazione completa diventando portatori di carica negativa. Le forme completamente ionizzate degli acidi aspartico e glutammico sono chiamate aspartato e glutammato. I nomi trasformati, dopo l'ionizzazione, indicano che in ambiente a pH fisiologico sono anioni. Il ruolo biologico degli aminoacidi, delle proteine e dei peptidi nel corretto funzionamento e rigenerazione dell'organismo
Aminoacidi con catene basiche
Aminoacidi con catene basiche. Al gruppo degli aminoacidi con catene basiche appartengono: lisina, arginina e istidina. Le catene laterali di questi aminoacidi contengono gruppi capaci di legare protoni. A questi gruppi appartengono il gruppo ε-amminico della lisina, il gruppo guanidinico dell'arginina e l'anello imidazolico dell'istidina. A pH fisiologico, i gruppi R di lisina e arginina sono completamente ionizzati, acquisendo così una carica positiva. L'aminoacido libero istidina ha un carattere leggermente basico, presentandosi in ambiente neutro nella forma neutra, a pH fisiologico. Tuttavia, può accadere che l'istidina nella proteina possieda un gruppo R carico positivamente o neutro, a seconda dell'ambiente creato dalla proteina. Questo gioca un ruolo importante nel funzionamento della proteina emoglobina.
Proteine
Caratteristiche delle proteine
Le proteine, come polimeri condensati di amminoacidi, che si trovano in gran numero nell'organismo umano, sono un componente strutturale fondamentale per il suo corretto funzionamento. Costituite esclusivamente da residui amminoacidici, sono definite proteine semplici o proteine. Le proteine complesse, proteidi, contengono inoltre un gruppo prostetico che non è un componente proteico. Come prodotti macromolecolari, si formano tramite l'interazione del gruppo α-carbossilico di un amminoacido con il gruppo α-amminico di un altro amminoacido, formando un legame peptidico. Possiamo chiamare polipeptidi le proteine la cui massa molecolare è superiore a 10000 dalton (Da). Tutte le proteine con massa molecolare inferiore sono definite oligopeptidi. Ogni proteina possiede una catena proteica composta da 100 a 1000 residui amminoacidici.
Struttura primaria
La struttura primaria della catena polipeptidica di una data proteina determina l'ordine (sequenza) di collegamento dei residui amminoacidici nella catena polipeptidica. I singoli amminoacidi sono collegati covalentemente tramite legami peptidici. Nelle proteine esistono solo determinate sequenze amminoacidiche a causa dell'ampia possibilità di combinazioni. La disposizione dei residui amminoacidici lungo la catena polipeptidica non è strettamente e chiaramente definita. Prendendo come esempio la molecola proteica dell'emoglobina, si può evidenziare l'importanza della struttura primaria. In questo caso, la sostituzione di un amminoacido con un altro provoca la formazione di emoglobina patologica. Per comprendere meglio l'essenza della sua formazione, ad esempio, nella posizione sesta, il glutammato viene sostituito da un altro amminoacido (valina o lisina), il che porta a conseguenze biologiche negative. I globuli rossi subiscono una trasformazione biologica, causando un cambiamento della loro forma in una forma atipica. I globuli diventano suscettibili all'emolisi, il che provoca contemporaneamente una diminuzione del numero di eritrociti nel sangue. I prodotti della degradazione degli eritrociti vengono catturati dal fegato e dalla milza e la concentrazione del pigmento biliare, cioè la bilirubina, aumenta a seguito della degradazione dell'eme nell'emoglobina. La conseguenza di questi processi è lo sviluppo di una condizione patologica chiamata anemia emolitica.
Struttura secondaria
Parlando della struttura secondaria, i termini fondamentali sono i concetti di configurazione e conformazione. Mentre la configurazione si riferisce ai legami geometrici tra insiemi specifici di atomi, la conformazione riguarda la struttura spaziale della proteina. Nel caso della configurazione, si verifica una mutua modifica della costruzione dei legami già formati, ad esempio la trasformazione della D-alanina in L-arginina. Tale conversione può essere ottenuta rompendo i legami covalenti esistenti e riformandoli. La conformazione, invece, non porta alla rottura dei legami covalenti, ma alla rottura e alla riformazione delle forze non covalenti, come i ponti a idrogeno o le interazioni idrofobiche. Solo alcune conformazioni risultanti hanno un significato biologico. La forma più comune della struttura secondaria delle proteine è l’elica α a spirale. Ogni giro dell’elica α comprende 3,6 residui amminoacidici. Il ruolo biologico degli amminoacidi, delle proteine e dei peptidi nel corretto funzionamento e rigenerazione dell’organismo. La forma specifica e diversa dalle altre a spirale permette la formazione di legami a idrogeno, sia intra-catena che inter-elica, con massima forza, grazie alla possibilità di interazioni elettrostatiche. La struttura dell’elica α, che include il legame peptidico della catena proteica, consente la partecipazione alla formazione di legami a idrogeno, ad eccezione di quelli che coinvolgono i gruppi imino della prolina. I polipeptidi ottenuti tramite sintesi da L-amminoacidi o D-amminoacidi formano spontaneamente la struttura dell’elica α. Nel caso di polipeptidi derivati da racemati amminoacidici e di polimeri di alcuni amminoacidi, come la prolina o l’idrossiprolina, non è presente la capacità di formare spontaneamente questa struttura. Ad esempio, l’α-cheratina, una proteina presente tra l’altro nei capelli, è quasi interamente costituita dalla struttura ad elica α, mentre il collagene o l’elastina, che contengono prolina e idrossiprolina, non hanno alcuna capacità di formare questa struttura.
Struttura terziaria
La struttura terziaria permette di mantenere la struttura secondaria, con un ripiegamento tridimensionale della molecola proteica. Il ruolo biologico degli amminoacidi, delle proteine e dei peptidi nel corretto funzionamento e nella rigenerazione dell'organismo 7. La disposizione spaziale della molecola proteica è principalmente determinata dalla struttura primaria, e indirettamente anche da quella secondaria. La struttura terziaria è stabilizzata dalle interazioni tra le catene laterali dei residui amminoacidici, nel caso di legami covalenti, inclusi i ponti disolfuro, così come da legami non covalenti a bassa energia, cioè legami a idrogeno. Nel caso di soluzioni acquose, la struttura delle proteine globulari è compatta. Le catene laterali idrofobiche dei residui amminoacidici sono nascoste all'interno della molecola, mentre i gruppi idrofili si trovano sulla superficie della molecola. I gruppi polari, inclusi quelli nascosti all'interno della molecola insieme agli elementi costitutivi dei legami peptidici, permettono la formazione di legami a idrogeno e di interazioni elettrostatiche. La struttura terziaria si forma solo quando esistono legami che consentono di unire residui amminoacidici distanti linearmente tra loro.
Struttura quaternaria
L'ultima delle strutture presentate si trova solo in alcune proteine e determina la disposizione spaziale e la composizione delle subunità rispetto a una singola molecola proteica. In questo caso, le proteine hanno un alto peso molecolare e sono composte da due o più monomeri, cioè catene peptidiche. Di solito, nella struttura quaternaria, gli elementi proteici coinvolti nella sua formazione sono collegati da legami a idrogeno a bassa energia. In alcuni casi, la struttura è stabilizzata da ponti disolfuro tra residui di cisteina. Nel caso del collagene e dell'elastina, i legami covalenti tra le subunità sono particolarmente stabili. Le proprietà biologiche della struttura quaternaria possono essere modificate da piccole molecole chiamate effettori allosterici. Nel caso dell'emoglobina e delle proteine enzimatiche, in particolare della lattato deidrogenasi, la struttura quaternaria è molto ben conosciuta. Il ruolo biologico degli amminoacidi, delle proteine e dei peptidi nel corretto funzionamento e nella rigenerazione dell'organismo.
Peptidi
Caratteristiche dei peptidi
I peptidi sono composti chimici costruiti in modo simile alle proteine, costituiti da amminoacidi. Sono oggetto di ampio interesse, svolgendo importanti funzioni biologiche. Molti ormoni e neurotrasmettitori sono proprio peptidi. Nel caso dei peptidi endogeni, essi agiscono contro i microrganismi, fungendo da sistema di difesa dell'organismo. I peptidi naturalmente presenti e i loro analoghi sintetici sono considerati composti attraenti di rilevanza terapeutica grazie all'elevato grado di attività, bassa tossicità e assenza di interazioni con farmaci. Nella pratica medica, solo pochi peptidi trovano applicazione a causa della loro instabilità biologica e rapida degradazione, tuttavia la sintesi dei peptidi consente di ottenere forme stabili. È simile il caso, ad esempio, della sintesi di peptidi da fonti naturali, utilizzati tra l'altro per la produzione di vaccini. Il prodotto che si forma dalla reazione di due amminoacidi è chiamato dipeptide, mantenendo un gruppo amminico libero di uno degli amminoacidi e un gruppo carbossilico libero dell'altro amminoacido. I peptidi composti da pochi fino a una dozzina di amminoacidi sono definiti oligopeptidi, mentre peptidi più lunghi, contenenti diverse decine di residui amminoacidici, sono chiamati polipeptidi. La nomenclatura dei peptidi inizia con il nome del residuo amminoacidico N-terminale, seguito dai nomi dei residui amminoacidici successivi e termina con il nome dell'amminoacido C-terminale. L'ordine degli amminoacidi è scritto usando simboli a tre lettere o a una lettera. I peptidi si presentano in forma lineare, possedendo solo due estremità specifiche. Una di queste è chiamata estremità amminica, dove si trova un amminoacido con un gruppo α-amminico libero. L'altra è chiamata estremità carbossilica o estremità C, dove si trova un amminoacido con un gruppo α-carbossilico libero.
Legame peptidico
Il carbonio, a seguito della reazione del gruppo α-carbossilico, si lega all'azoto del gruppo α-amminico tramite un legame singolo, il legame peptidico. Si presume che questo legame si formi in due strutture che rimangono in un equilibrio reciproco definito. Il legame C-N si trasforma in C=N e viceversa. La rotazione attorno all'asse C=N non è possibile, per cui il legame peptidico è sufficientemente rigido da possedere caratteristiche di un legame doppio. Il ruolo biologico degli amminoacidi, delle proteine e dei peptidi nel corretto funzionamento e nella rigenerazione dell'organismo 9 Nel caso del legame peptidico che coinvolge il gruppo imino della prolina o dell'idrossiprolina con il gruppo carbossilico di un altro amminoacido, si forma una struttura diversa e distinta. L'azoto in questo caso è incorporato nella struttura dell'anello pirolidinico, non è presente un sostituente idrogeno, per cui non è possibile la rotazione attorno ai legami che si formano in presenza di azoto. Gli amminoacidi che partecipano alla formazione del legame peptidico perdono frammenti molecolari. Si tratta di molecole -OH dal gruppo carbossilico e -H dal gruppo amminico. Per questo motivo, gli amminoacidi presenti nei peptidi e nelle proteine sono chiamati residui amminoacidici. I legami peptidici formati sono stabili e la loro rottura può avvenire solo sotto l'azione di basi e acidi forti, contemporaneamente ad alte temperature.
Peptidi biologicamente attivi
Gli ormoni peptidici e gli ormoni proteici sono comunemente presenti nell'ambiente che ci circonda. In precedenza erano conosciuti principalmente come forme poco stabili. Sotto l'influenza della sintesi, è possibile selezionare con sempre maggiore sicurezza una terapia peptidica che sia duratura ed efficace a seconda delle esigenze dell'organismo. Per questo motivo vale la pena giocare abilmente e in sicurezza con la stimolazione degli ormoni. Considerando alcuni peptidi biologicamente attivi, possiamo fare l'esempio del glutatione, che essendo un tripeptide con una struttura specifica è composto da glutammato, cisteina e glicina. Il glutammato si presenta come amminoacido N-terminale. Tuttavia, la connessione tra glutammato e cisteina è atipica per peptidi e proteine, poiché qui non è presente il gruppo α-carbossilico del glutammato, ma il gruppo γ-carbossilico. Il glutatione, quindi, si presenta in forma ridotta e ossidata, essendo γ-glutamilcisteinilglicina. Nella forma ridotta possiede un gruppo sulfidrilico libero, mentre nella forma ossidata avviene il distacco di una coppia di atomi di idrogeno dai gruppi –SH. Gli atomi di zolfo rimangono privi di idrogeno, con la conseguenza della formazione di un ponte disolfuro. Le capacità modificative del glutatione in forma ossidata o ridotta sono importanti nei processi ossido-riduttivi. Un altro esempio sono l'ossitocina e la vasopressina, che essendo nanopeptidi prodotti dai neuroni dell'ipotalamo e rilasciati dal lobo posteriore dell'ipofisi, differiscono solo per due amminoacidi. La cisteina si trova in due posizioni, portando così alla formazione di un ponte disolfuro. L'ossitocina agisce come ormone che stimola l'attività contrattile dell'utero. La vasopressina invece stimola il riassorbimento dell'acqua nei tubuli renali. La vasopressina svolge anche un ruolo importante nella regolazione della secrezione dell'ormone adrenocorticotropo (ACTH) in situazioni di stress. Il ruolo biologico degli amminoacidi, delle proteine e dei peptidi nel corretto funzionamento e nella rigenerazione dell'organismo.
Ormoni peptidici
Ormone adrenocorticotropo (ACTH)
L'ormone adrenocorticotropo, come peptide di 39 amminoacidi, deriva dalla degradazione di una molecola precursore molto più grande chiamata pro-opiomelanocortina (POMC). La pro-opiomelanocortina è anche fonte di altri peptidi attivi. Due peptidi sono contenuti proprio nella struttura dell'ACTH. Essi includono l'ormone α-melanotropo (α-MSH), che nella struttura è identico ai primi 13 amminoacidi dell'ACTH, e il peptide della parte intermedia dell'ipofisi simile alla corticotropina - frammento 18-39 dell'ACTH. La funzione principale dell'ACTH è stimolare la corteccia surrenale affinché sia in grado di secernere ormoni steroidei. L'ormone adrenocorticotropo è responsabile della regolazione dell'attività a livello degli strati fascicolato e reticolare. L'attività biologica dell'ACTH è attribuita ai primi 18 amminoacidi. La regolazione dell'ACTH avviene tramite la corticoliberina (CRH), un ormone presente nell'ipotalamo, che libera la corticotropina tramite il cortisolo attraverso un feedback negativo. Ciò significa che la carenza di cortisolo stimola la CRH e l'ACTH, mentre un eccesso ne inibisce la secrezione. Così, il rilascio di cortisolo regola molte funzioni vitali importanti, tra cui la mobilitazione dell'organismo in condizioni di stress, l'aumento della pressione sanguigna e le capacità antinfiammatorie. L'ACTH viene secreto in modo pulsatile con un ritmo circadiano, il che significa che la sua concentrazione più alta si osserva nelle ore mattutine, quando è più necessaria, per poi diminuire nel corso della giornata. L'aumento della secrezione di ACTH si osserva in condizioni patologiche come l'insufficienza della corteccia surrenale, la malattia di Cushing o la sindrome di Nelson.
Insulina e peptide C
Insulina e il peptide C sono secreti nel pancreas dall'organismo umano continuamente. Durante la produzione di insulina, nel processo della sua biosintesi, viene prodotto il peptide C. Le cellule pancreatiche producono nella prima fase la preproinsulina che subisce ulteriori modifiche mediante il distacco di amminoacidi, portando alla formazione della proinsulina composta da due catene A e B, collegate dal peptide C; successivamente avviene il distacco del peptide C dalla proinsulina, che porta alla formazione della forma finale. Quando nel corpo compare il glucosio, il pancreas riceve il segnale per rilasciare le granuli contenenti la molecola immagazzinata di insulina e peptide C. Il ruolo biologico degli amminoacidi, delle proteine e dei peptidi nel corretto funzionamento e rigenerazione dell'organismo. Il peptide C viene mantenuto nel fegato molto più a lungo rispetto all'insulina, poiché non viene degradato in esso. La sua degradazione avviene principalmente nei reni. Nel caso sia dell'insulina che del peptide C, una concentrazione elevata o troppo bassa porta allo sviluppo del diabete di tipo I o II, nonché alla malattia di Cushing. Nel caso del peptide C, le fluttuazioni della concentrazione possono indicare anche insufficienza renale cronica o la presenza di metastasi o recidive locali del tumore, perciò è molto importante mantenere i livelli normali della loro concentrazione.
Motilina
La motilina è un ormone legato ai muscoli lisci dello stomaco e dell'intestino, controllato dalle fibre del nervo vago. Sintetizzata nelle cellule endocrine. Come ormone peptidico, composto da 22 amminoacidi disposti in una sequenza specifica, è prodotta dalle cellule dell'intestino tenue. Prodotta dalle cellule endocrine del sistema digestivo M (Mo), partecipa alla regolazione della motilità del tratto gastrointestinale. La motilina è un ormone importante coinvolto nella formazione della terza fase del complesso motorio migrante (MMC), durante la quale stomaco e intestino tenue hanno il compito di svuotare lo stomaco dai residui alimentari inutili e dalle cellule epiteliali desquamate, stimolando i movimenti peristaltici. L'ormone influisce inoltre sullo svuotamento della cistifellea durante il periodo interdigestivo, quando la concentrazione di motilina è al massimo.
Glucagone
Il glucagone è uno degli ormoni coinvolti nella regolazione della concentrazione di glucosio, questo peptide è secreto dalle cellule endocrine del pancreas. È un polipeptide composto da 29 amminoacidi, derivante da un precursore di 180 amminoacidi. Le variazioni della concentrazione di glucosio permettono la secrezione del glucagone. La produzione dell'ormone glucagone avviene nelle isole pancreatiche, dove dal proglucagone si formano sia il glucagone che il peptide pancreatico glicentin-dipendente (GRPP). Il compito principale del glucagone è mantenere una corretta concentrazione di glucosio nel siero durante il suo calo tra i pasti o durante l'attività fisica. Le sue riserve in tali situazioni vengono rilasciate dal fegato per garantire all'organismo una protezione adeguata. Inoltre, può partecipare alla regolazione durante l'assunzione di cibo, facendo sì che la sensazione di sazietà possa comparire prima. Il glucagone può potenzialmente inibire il rilascio della grelina e anche inibire la peristalsi intestinale. Il ruolo biologico degli amminoacidi, delle proteine e dei peptidi nel corretto funzionamento e rigenerazione dell'organismo
Ormoni proteici
Ormone della crescita HGH L'ormone della crescita HGH è anche chiamato somatotropina. Viene prodotto dalle cellule acidofile appartenenti al lobo anteriore dell'ipofisi. L'ormone porta ad un aumento della proliferazione delle cellule di vari tessuti, con conseguente aumento del loro numero e dimensione. L'HGH è composto da 190 amminoacidi in forma di una semplice catena polipeptidica. Nell'organismo viene rilasciato in modo pulsatile ogni circa 3-4 ore e le sue concentrazioni più elevate si registrano durante la notte. Il processo di secrezione dell'ormone è regolato dagli ormoni dell'ipotalamo caratterizzati da azioni opposte. Tra questi ormoni vi sono l'ormone che induce il rilascio dell'ormone della crescita GN-RH e l'ormone che ne inibisce il rilascio SRIF. Durante il rilascio della somatotropina, questo processo è regolato da neuroormoni: somatoliberina (GHRH), somatostatina (GHIH), grelina, glucocorticoidi, acidi grassi, glucosio, insulina e ormoni sessuali. L'ormone della crescita regola i processi metabolici, la modulazione della crescita dell'organismo, la stimolazione e proliferazione cellulare. L'azione dell'HGH è piuttosto ampia e comprende, tra l'altro, la stimolazione della crescita delle ossa lunghe, la sintesi degli acidi nucleici, la regolazione del metabolismo dei carboidrati. L'ormone della crescita ha un ampio impiego tra gli sportivi. La somministrazione di somatotropina negli sportivi influisce sul rafforzamento, costruzione muscolare e minimizzazione degli infortuni durante gli allenamenti, attraverso lo sviluppo del tessuto connettivo che forma le cartilagini. Nel decidere di assumere l'ormone della crescita è importante mantenere anche altri fattori come un'adeguata quantità di sonno e una dieta appropriata. Ruolo biologico degli amminoacidi, delle proteine e dei peptidi nel corretto funzionamento e rigenerazione dell'organismo
Conclusioni
Come sopra menzionato, amminoacidi, proteine e peptidi partecipano al corretto funzionamento dell'organismo. Nel caso dei peptidi si può dedurre che il loro uso sapiente consente una terapia sanitaria sicura, efficace e soddisfacente. Considerando la loro azione, sono indicati per l'uso in quasi tutti i casi e per tutte le persone. Sono particolarmente raccomandati agli sportivi per scopi rigenerativi e preventivi. La carenza sia di ormoni proteici che di ormoni peptidici può portare a gravi disturbi nel funzionamento dell'organismo. Ruolo biologico degli amminoacidi, delle proteine e dei peptidi nel corretto funzionamento e rigenerazione dell'organismo.
Bibliografia:
- Bańkowski.E, Biochimica. 2020; 160(1-3):33-41
- Dryweń.M, Dźwigała J, Importanza degli amminoacidi ramificati nella nutrizione umana e nella prevenzione e decorso di alcune malattie. Medicina Generale e Scienze della Salute; 2013; 3(1) 379-384
- Darewicz.M, Borawska J, Minkiewicz P, Peptidi biologicamente attivi rilasciati dalle proteine alimentari. 2015; 3(100) 26-41; DOI:10.15193/zntj/2015/100/037
- Miyamoto.T, Rilevamento e quantificazione dei residui di d-amminoacidi in peptidi e proteine mediante idrolisi acida. 2018; 775-782; DOI:10.1016/j.bbapap.2017.12.010
- Bottecchia.C, Modifica fotocatalitica di amminoacidi, peptidi e proteine. 2018; 26-42; DOI:10.1002/chem.201803074
- Rutherfurd M, Analisi degli amminoacidi. 2009; 11.9.1-11.9.37; DOI:10.1002/0471140864.ps1109s58
- Rob.M, Liskamp.J, Peptidi e proteine come fonte continua ed entusiasmante di ispirazione per i peptidomimetici. 2011; 1626-1653; DOI:10.1002/cbic.201000717
- Lewandowski K, Lewiński A, Ormoni peptidici secreti nel tratto gastrointestinale. 2012: 12(1) 10-14
- Klein A. Meccanismi molecolari della regolazione ormonale. Casa editrice dell'Università Jagellonica. 2010; 200-233
- Marciniak. P, Szymczak.M, Ormoni peptidici. Progressi nella biologia cellulare. 2011; 43-63
- O’Neill.R, Murphy.R, Endocrinologia. 2012; 30-45
- Siewko.K, Szelachowska.M, Peptide C come fattore di rischio per lo sviluppo del diabete di tipo 1 nei parenti di primo grado di persone affette da diabete autoimmune. P2009; 60(5) 26-43
- Romański.K, Goździewska.K, Grelina e motilina: somiglianze e differenze nella regolazione dell'attività motoria del tratto gastrointestinale. 2008; 64(11) 5-19
- Nylec.M, Olszanecka.M, Il ruolo del glucagone nella patogenesi del diabete di tipo II. 2010; 1734-3321
- Hsiao.Y, Yamada.M, I ruoli degli ormoni peptidici e dei loro recettori durante lo sviluppo delle radici delle piante. 2020; 12(1) 22; DOI:10.3390/genes12010022
- Imura.H, Nakai Y, Tanaka N, ACTH e peptidi correlati. 2000; 41(5) 949-56
- Brownstein M, Ormone adrenocorticotropo nel sistema nervoso centrale. 2000; 22: 93-9
- Itoh. A, Motilina e applicazione clinica. 2001; 593-608; DOI:10.1016/S0196-9781(96)00333-6 19. Chen.C, Grelina e Motilina nel sistema gastrointestinale. 2012; DOI:10.2174/138161212803216915
- Drucker.D, Meccanismi d'azione e applicazione terapeutica del peptide-1 simile al glucagone. Metabolismo cellulare, 2018: 740-756; DOI:10.1016/j.cmet.2018.03.001
- Bildingmaier. M, Ormone della crescita. 2009; 187-200
- Lee.S, Park.H, Valutazione della bioefficacia di una forma stabilizzata di ormone della crescita umano (SP-hGH). 2013; 45(10):722 -727; DOI:10.1055/s-0033-1345126
- Maciejewska.Z, Korek.E, Il ruolo dell'ormone della crescita, del fattore di crescita insulino-simile di tipo 1 e della grelina. 2016; 216-220





BPC-157 Prodotto dell'anno 2020! Innovazione al primo posto!
Azione neuroprotettiva e antidepressiva del BPC-157. Effetto del BPC-157 sul funzionamento del cervello.