Synthagen Laboratories
Technologie NL-PEPTIDE-ÜBERTRAGUNG™ als neuartige Methode zur Herstellung von Peptiden der neuen Generation Vergleich der Wirkung und Stabilität traditioneller Peptide im Vergleich zur neuartigen Methode der Synthese und oralen Abgabe von Peptiden.
Zusammenfassung: In der Praxis finden nur wenige traditionelle Peptide Anwendung, da sie biologisch instabil sind und schnell abgebaut werden. Die Lösung dieses Problems ist die Peptidmodifikation, die stabile und wirksame Peptidformen ermöglicht. Peptide der neuen Generation, die durch Synthese mittels der NL-PEPTIDES-Technologie hergestellt werden, sind in einer Doppelkapselform eingeschlossen, die im System NL-PEPTIDES DELIVERY ™ entwickelt wurde, um die Wirkung und Stabilität des Peptids zu maximieren.
Abkürzungsverzeichnis: •AFP- Aktiv Pharmakologisch Peptide • NL-PEPTIDES- Peptide der neuen Generation •NL-PEPTIDES DELIVERY- Technologie der oralen Abgabe
Schlüsselwörter: •Peptid •Peptidbindung• Analogon• Modifikation• Ausfällung• Amidierung• Acetylierung •Synthese• Technologie• Ausfällung• Arginin
Einführung
Die Technologie NL-PEPTIDES DELIVERY ™ ermöglicht als innovative Methode einen therapeutischen Effekt, der die Wirkung traditioneller Peptide übertrifft. Die Wirksamkeit von NL-PEPTIDES DELIVERY ™ wurde anhand der Reaktion auf Fragestellungen zur Peptidproduktion bestätigt, bei der die Peptide unversehrt den Darm erreichen und dort vollständig resorbiert werden. Die neuartige Technologie NL-PEPTIDES DELIVERY ™ ist durch Patentrecht als neue Form von Peptid-Analoga geschützt, mit dem Ziel der Entwicklung und Kommerzialisierung oraler Peptide mit einem speziellen Abgabesystem.
WAS SIND TRADITIONELLE PEPTIDE
Aus rein chemischer Sicht treten Peptide in unverzweigter Form auf und besitzen nur zwei spezifische Enden. Eines davon wird als Aminoende bezeichnet, an dem die Aminosäure mit einer freien Gruppe vorkommt α-aminogruppe. Die zweite wird als Carboxylende oder C-Ende bezeichnet, an dem die Aminosäure mit einer freien Gruppe vorkommt α-carboxylgruppe. Peptide sind chemische Verbindungen, die ähnlich wie Proteine aus Aminosäuren aufgebaut sind. Sie sind Gegenstand intensiven Interesses und erfüllen wichtige biologische Funktionen. Viele Hormone sowie Neurotransmitter sind tatsächlich Peptide. Im Fall endogener Peptide wirken sie antimikrobiell und fungieren als Abwehrsystem des Körpers. Natürlich vorkommende Peptide gelten aufgrund ihrer hohen Aktivität, niedrigen Toxizität und fehlenden Wechselwirkungen mit Medikamenten als attraktive Verbindungen mit therapeutischer Bedeutung. In der medizinischen Praxis finden nur wenige Peptide Anwendung, da sie biologisch instabil sind und schnell abgebaut werden. Die Lösung dieses Stabilitätsproblems liegt in der Synthese, die die Herstellung stabiler Peptidformen ermöglicht. Ähnlich verhält es sich bei der Synthese von Peptiden aus natürlichen Quellen, die unter anderem zur Herstellung von Impfstoffen verwendet werden.
PEPTIDBINDUNG
Kohlenstoff, als Ergebnis der Reaktion der Gruppe α-carboxylgruppe bindet sich an den Stickstoff der Gruppe α-aminogruppe durch eine Einfachbindung, die Peptidbindung. Es wird angenommen, dass diese Bindung in Form von zwei Strukturen vorliegt, die in einem bestimmten Gleichgewicht zueinander stehen. Die C-N-Bindung wechselt zu C=N und umgekehrt. Eine Rotation um die C=N-Achse ist nicht möglich, wodurch die Peptidbindung so starr ist, dass sie Eigenschaften einer Doppelbindung besitzt. Aminosäuren, die an der Bildung der Peptidbindung beteiligt sind, verlieren Molekülfragmente. Dies sind -OH-Moleküle aus der Carboxylgruppe und -H aus der Aminogruppe. Deshalb nennen wir die Aminosäuren, die in Peptiden und Proteinen vorkommen, Aminosäurereste. Die entstandenen Peptidbindungen sind stabil und können erst unter Einwirkung starker Basen und Säuren bei gleichzeitig hoher Temperatur gespalten werden.
PEPTIDSYNTHESE
Je nach Peptid, das wir erhalten möchten, benötigen wir die entsprechende Methode seiner Synthese. In einer kurzen Erklärung versuchen wir, die Peptidsynthese im Bezug auf abhängig von seiner Größe. Zur Herstellung des Dipeptids sollte ein Reagenz verwendet werden, das zu Aktivierung der Carboxylgruppe der acylierenden Aminosäure oder eine Änderung Aminosäure in ein Anhydrid acyliert. Ein arbeitsintensiverer und schwierigerer Prozess ist die Synthese bei größeren Peptiden, die aus Dipeptiden gewonnen werden, wo es zu Entfernung des Schutzes der Aminogruppe der N-terminalen Aminosäure und deren Acylierung mit der nächsten mit N-geschützter Aminosäure. Dieser Prozess ist besonders zeitaufwendig, da die genannten Schritte werden wiederholt, bis das geplante Peptid erreicht ist Sequenz. Bei der Herstellung großer Peptide ist dies die am besten geeignete und die einfachste Methode ist die Merrifield-Methode. Diese Methode wird in der Phase Konstante. Die C-terminale Aminosäure wird an das Polymer gebunden, wo anschließend einer weiteren Aminosäure, bis die gewünschte Länge erreicht ist łKette.
PEPTID-ANALOGE
Als Reaktion auf die instabile Natur traditioneller Peptide werden deren Analoga entworfen und hergestellt. Peptidanaloga nennen wir entsprechende chemische Verbindungen, dank bei denen ein Atom im Vergleich zur Ausgangsverbindung durch ein anderes ersetzt ist. Allgemein die Peptidstruktur bleibt unverändert. Zu den Peptidanaloga gehören Analoga mit Helixstruktur sowie Analoga β–Biegungen und β–Blätter. Im ersten davon Helix sind eines der Schlüsselelemente der Struktur bioaktiver Peptide. Die Stabilisierung kurzer Oligomerfragmente in einer helikalen Konformation führt zu einer erhöhten Aktivität. In den Analogien β–Biegungen und β–Blätter erfolgt das Einfügen von D-Aminosäureresten oder β,γ,δ-aminosäurehaltig. Peptidanaloga ermöglichen es uns, neue peptidische Verbindungen zu erhalten, die stabiler sind und gleichzeitig in einem breiteren symptomatischen Spektrum Anwendung finden sowie innovative Lösungen für Probleme bieten, die mit den bisherigen Vorläuferformen verbunden sind.
PEPTIDANALOGA DURCH MODIFIKATION
Traditionelle Peptide besitzen trotz ihrer unbestreitbaren und zahlreichen Vorteile auch viele Einschränkungen in Bezug auf ihre Anwendung. Die Suche nach neuen, maximal stabilen Peptidanaloga mit einem breiten Wirkungsspektrum ist eine Folge der Instabilität traditioneller Peptide. Analoga traditioneller Peptide die die Sequenz enthalten Schlüsselpeptid sind mit Modifikationen innerhalb der Kette angereichert peptidischer oder Seitenkettenreste von Aminosäuren, die in der Sequenz vorhanden sind. Die Einführung von Amidierung und Acetylierung trägt zur Verbesserung der metabolischen Stabilität sowie Selektivität. Zu den bekannten Beispielen für Modifikationen, abhängig vom Wirkprofil, das Zu den Merkmalen, die ein Peptid aufweisen kann, gehören u.a. die Acetylierung des N-Terminus, Zyklisierung, Markierung mit Fluorophoren, Amidierung des C-Terminus des Peptids oder D-Aminosäuren.
AUSFÄLLUNGSPROZESS VON PEPTIDEN
Der Ausfällungsprozess beruht auf der Veränderung der Proteinladungen. Die Proteinladungen werden durch Anionen und Kationen von Salzen neutralisiert. Die Proteinmoleküle ziehen sich nicht an und bilden keine Aggregate, und das Protein selbst wird durch den Verlust der Wasserschicht ausgefällt. Der Ausfällungsprozess ist reversibel. Beim Rückprozess wird das Salz durch Dialyse entfernt oder seine Konzentration durch Zugabe von Wasser verringert. Die Ausfällung durch Zugabe von Argininmolekülen führt zur Bildung einer stabilen Peptidform und ist eine innovative Methode zur Sicherung der Peptidstabilität und damit zur Erweiterung der biologischen Wirkung von Peptiden.

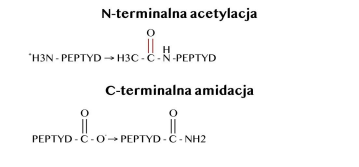
ACETILIERUNG UND AMIDIERUNG VON PEPTIDEN
Die Acetylierung des N-Terminus eines Peptids besteht in der Anlagerung von Acetylgruppen an Substrate, die Verbindungen mit NH2-, OH- oder SH-Gruppen sind, unter Beteiligung des Enzyms N-Acetyltransferase. Die Quelle der Acetylgruppe ist Acetyl-CoA. Die Hauptfunktion der N-Acetyltransferasen besteht darin, die Verbindung der Acetylgruppe mit der Aminogruppe aromatischer Amine und Hydrazine (N-Acetylierungsreaktion) zu erleichtern, also die Entgiftung potenziell toxischer exogener Verbindungen. Wenn Peptidbindungen aufbrechen und infolgedessen die Polypeptidkette fragmentiert wird, entstehen Carbonylgruppen. Die Oxidation des Proteinmoleküls durch das Hydroxylradikal beginnt mit der Abspaltung eines Wasserstoffatoms am Kohlenstoff α einer Aminosäure. Das entstehende Alky-Radikal reagiert mit Sauerstoff und bildet ein Alkylperoxylradikal, das zu einem Alkylhydroperoxid übergeht. Das daraus entstehende Alkoxylradikal kann sich an einem Kohlenstoff hydroxyliert umwandeln. α eine Aminosäurerestgruppe oder kann zur Fragmentierung der Polypeptidkette führen. Das Vorhandensein eines Alkoxylradikals begünstigt die Fragmentierung der Polypeptidkette. Die Spaltung der Peptidbindung kann über α-amidierung oder Diamidierung. Entstehend während αBei der -amidischen Fragmentierung hat das N-terminale Peptid am C-Terminus eine Amidgruppe, während das zweite Peptid am N-Terminus eine N-derivatisierte Gruppe enthält.α-ketoacyl. Die Fragmentierung über den Diamid-Weg ist durch die Entstehung eines N-terminalen Peptids mit einer Diamid-Struktur und eines Peptids vom C-Terminus des Proteins gekennzeichnet, das am N-Terminus eine Isocyanat-Struktur enthält.
WAS SIND NL-PEPTIDES™
Als Antwort auf die Herausforderungen bei der Herstellung von Peptiden, die unversehrt den Darm erreichen, haben wir eine Gruppe neuer Peptide entwickelt, die NL-Peptide genannt werden und auch als Peptide der neuen Generation bezeichnet werden, gekennzeichnet durch das Kürzel AFP. Die Eigenschaften pharmakologisch aktiver Peptide spiegeln ihre Überlegenheit gegenüber herkömmlichen Peptiden wider. Sie zeichnen sich vor allem durch eine verlängerte Lebensdauer und Beständigkeit gegenüber pH- und Temperaturänderungen, sowohl während der Lagerung des Produkts als auch im Verdauungstrakt, wo das Peptid beim Einnehmen der Kapsel und deren Transport in den Dünndarm nicht degradiert wird. Die Gruppe der NL-Peptide zeichnet sich durch die Fähigkeit aus, natürlich vorkommende Proteine zu imitieren, sowie durch eine hohe metabolische Stabilität, wodurch NL-Peptide, die wie natürliche Proteine wirken, unverändert aus dem Darm aufgenommen werden und während der Absorption nicht abgebaut werden.
ENTSTEHUNG VON NL-PEPTIDES ™ DURCH SYNTHESEN
Die chemische Darstellung der NL-Peptide, die durch Modifikationen im Syntheseprozess entstanden sind, wird unten erläutert, Die Technologie, die auf der Ausfällung des Peptids mit Arginin basiert, wurde durch die Synthese mittels N-Acetylierung des aminoterminalen Endes des Peptids bei gleichzeitiger Amidierung des carboxylterminalen Endes der Bindung erweitert. Der gesamte durchgeführte Modifikationsprozess führt zu einer 10-fachen Erhöhung der Stabilität der NL-PEPTIDE sowie zu der erwähnten Fähigkeit, natürliches Protein zu imitieren.
TECHNOLOGIE NL-PEPTIDES DELIVERY ™
Bei der Aufgabe, eine moderne Technologie für die orale Peptidabgabe zu entwickeln, war es wichtig, Probleme zu lösen, die erstens die Schaffung einer einfachen Technologie betreffen, die auf Vielseitigkeit für eine breite Produktpalette basiert, sowie zweitens die gleichzeitige Produktion mehrerer effektiver Produkte in einem Zeitraum durch eine Methode, die die Entwicklung eines Systems ermöglicht, das ein solches Vorgehen erlaubt. Bisherige Probleme im Zusammenhang mit der Absorption wurden durch die Anwendung der erwähnten Peptidmodifikationen gelöst. In unserem Fall haben wir uns neben der Modifikation des Peptids zweifellos auf die wichtige Lösung des Problems konzentriert, das mit dem Transport des Peptids vom Zeitpunkt der oralen Verabreichung über den Übergang in den Dünndarm bis zum Zeitpunkt der Absorption der Verbindung zusammenhängt. Die Lösung der genannten technologischen Probleme ist die Entstehung einer neuen, einfachen und effektiven Peptidabgabetechnologie, die wir als NL-PEPTIDES-DELIVERY ™ bezeichnen.
WIRKPROFIL DER TECHNOLOGIE NL-PEPTIDES DELIVERY ™
Das Wirkprofil, basierend auf der Technologie NL-PEPTIDES DELIVERY, ermöglicht vor allem das Erreichen des Peptids im Dünndarm durch eine speziell zu diesem Zweck entwickelte Hülle, die das NL-Peptid umgibt. Neben dem eigentlichen Erreichen des Peptids im Dünndarm ist es wichtig, dass das gesamte lokale Milieu im Darm die Aufnahme des an dieser Stelle zugeführten Peptids begünstigt. Das Problem war aufgrund der im Darm vorkommenden Enzyme – Peptidasen, die Peptide abbauen – erheblich. Die Hauptenzyme, die Peptide abbauen, sind proteolytische Enzyme, sogenannte Proteasen, die den weiteren Weg des Peptids verhindern, indem sie es im Dünndarm degradieren. Ein Problemfaktor, den wir gelöst haben, ist die schlechte Absorption des Peptids selbst durch die Wand des Dünndarms.
VORTEILE DER TECHNOLOGIE NL-PEPTIDES DELIVERY ™
Der spezifische Wirkungsmechanismus der Technologie NL-PEPTIDES DELIVERY ™ besteht in der Entwicklung einer neuen Doppel-Kapsel mit Schutzschichten, die das Problem sowohl des Erreichens des Dünndarms durch das Peptid als auch dessen Passage durch die Darmwand und den Abbau des Peptids an dieser Stelle löst. Die schützende Hülle, die die äußerste Oberfläche der Kapsel bildet, schützt die Verbindung vor pH-Änderungen und Magensäure, wodurch das Peptid den Darm erreicht. Durch den Einsatz eines Proteaseinhibitors in der Kapsel wird das Peptid, das sonst abgebaut werden könnte, nicht zersetzt, während gleichzeitig der lokale pH-Wert des Darms gesenkt und dessen Milieu für die Peptidabsorption vorbereitet wird. Ein Absorptionsverstärker wurde eingesetzt, um die Aufnahme des Peptids durch den Dünndarm zu verbessern. Das NL-Peptid wurde mit einer Schicht umgeben, die es vom Proteaseinhibitor trennt. Der Inhibitor selbst ist eine Säure, die in Verbindung mit dem Peptid dieses abbauen könnte. Durch die Trennung von der Säure mittels Kapsel-in-Kapsel-Technik haben wir eine stabile, während der Lagerung nicht abbaubare pharmazeutische Komposition erzielt.
FUNKTIONSWEISE DER TECHNOLOGIE NL-PEPTIDES DELIVERY ™ IM VERDAUUNGSTRAKT
Peptide der neuen Generation, die durch Synthese mit der Technologie NL-PEPTIDES entstanden sind. Eingeschlossen in einer Doppel-Kapsel, die im System NL-PEPTIDES DELIVERY ™ entwickelt wurde und beim oralen Einnehmen einen definierten Weg im Verdauungstrakt durchläuft. Die geschluckte Kapsel gelangt unversehrt in den Dünndarm, wo der Proteaseinhibitor freigesetzt wird, wodurch durch Senkung des pH-Werts des Darms auf 5,5 ein geeignetes Absorptionsmilieu geschaffen wird. Im nächsten Schritt erfolgt die Freisetzung des aktiven Wirkstoffs und des Absorptionsverstärkers, wodurch das Peptid effektiv im Körper aufgenommen wird.
ERGEBNISSE DER ANWENDUNG DER TECHNOLOGIE NL-PEPTIDES DELIVERY ™
Der Vergleich der Ergebnisse der oralen Verabreichung in Form einer Doppel-Kapsel mit der nasalen Verabreichung des Peptids ermöglicht die Bestimmung der Überlegenheit und Wirksamkeit einer der Verabreichungsmethoden. Die Peptidkonzentration zum Zeitpunkt der oralen Verabreichung unserer Kapsel ist deutlich höher als bei der nasalen Verabreichung. Bei der Studie wurden dieselben Peptiddosen in der Kapsel und im Nasenspray verwendet. Die Ergebnisse dieser Studien zeigen die Überlegenheit unserer Technologie gegenüber der nasalen Verabreichung.
ERGEBNIS DER ARBEIT VON SYNTHAGEN LABORATORIES
Die Aufgabe, die wir uns gestellt haben, betraf die Entwicklung einer neuen Technologie, die die Wirksamkeit von Peptiden erhöht. Die Technologie der oralen Peptidverabreichung NL-PEPTIDES-DELIVERY basiert auf innovativer Peptidtherapie zusammen mit einer von uns entwickelten neuartigen oralen Verabreichungsmethode. Die mehrkanalige Darstellung unserer Technologie in Form einer Präsentation ermöglicht ein genaues Verständnis jeder ihrer Phasen.
Anschaulich sind die Ergebnisse unserer Arbeit in der Präsentation zu sehen





Peptide mit antimikrobiellen Eigenschaften und ihre durch Modifikation entstandenen Analoga.
Die Rolle des Peptids NL GHK-Cu bei den Prozessen der Wiederherstellung und Erneuerung von Haut und Haaren