Schlüsselwörter: Peptid; Peptidhydrolyse; Peptidbindungen; Peptidmodifikationen, Peptidsynthese; Peptidbindung; Peptidhormone; Peptidanaloga; Aussalzen; Amidierung; Acetylierung
Peptide
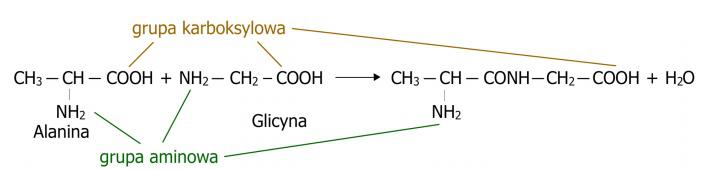
Peptide sind chemische Verbindungen, die ähnlich wie Eiweiße aus Aminosäuren aufgebaut sind. Sie entstehen durch die Verbindung von zwei oder mehr Aminosäuren mittels einer Peptidbindung im Zuge eines Kondensationsprozesses, bei dem neben dem Peptid auch ein Wassermolekül entsteht. (Abb. 1) Sie sind Gegenstand großen Interesses, da sie wichtige biologische Funktionen erfüllen. Viele Hormone und Botenstoffe sind Peptide. Endogene Peptide wirken antimikrobiell und dienen als Abwehrsystem des Körpers. Natürlich vorkommende Peptide sowie ihre synthetischen Analoga gelten als attraktive Verbindungen mit therapeutischer Bedeutung aufgrund ihrer hohen Aktivität, geringen Giftigkeit und fehlenden Wechselwirkungen mit Arzneimitteln. In der medizinischen Praxis finden nur wenige Peptide Anwendung, da sie biologisch instabil sind und schnell zerfallen, doch die Peptidsynthese ermöglicht die Herstellung stabiler Formen. Ähnlich verhält es sich beispielsweise bei der Synthese von Peptiden aus natürlichen Quellen. Peptide liegen in unverzweigter Form vor und besitzen nur zwei spezifische Enden. Eines davon wird Aminoende genannt, an dem sich eine Aminosäure mit freier α-Aminogruppe befindet. Das andere wird Carboxylende oder C-Ende genannt, an dem eine Aminosäure mit freier α-Carboxylgruppe sitzt.
Peptidbenennung
Die Benennung von Peptiden beginnt mit dem Namen der Aminosäurerest am N-Terminus, gefolgt von den Namen der weiteren Aminosäurereste, und endet mit dem Namen der Aminosäure am C-Terminus. Die Reihenfolge der Aminosäuren wird mit dreibuchstabigen oder einbuchstabigen Symbolen angegeben.
Peptidbindung
Der Kohlenstoff der α-Carboxylgruppe verbindet sich durch eine Einfachbindung mit dem Stickstoff der α-Aminogruppe, wodurch die Peptidbindung entsteht. Man nimmt an, dass diese Bindung in Form zweier Strukturen vorliegt, die sich in einem bestimmten Gleichgewicht befinden. Die C-N-Bindung wechselt zwischen C=N und zurück. Eine Drehung um die C=N-Achse ist nicht möglich, weshalb die Peptidbindung so starr ist, dass sie Eigenschaften einer Doppelbindung besitzt. Bei der Peptidbindung, an der die Iminogruppe von Prolin oder Hydroxyprolin mit der Carboxylgruppe einer anderen Aminosäure beteiligt ist, entsteht eine andere, eigenständige Struktur. Der Stickstoff ist hier in die Pyrrolidinringstruktur eingebaut, es gibt keinen Wasserstoffsubstituenten, wodurch keine Rotation um die Bindungen möglich ist, die Stickstoff enthalten. Aminosäuren, die an der Bildung der Peptidbindung beteiligt sind, verlieren Molekülfragmente: -OH von der Carboxylgruppe und -H von der Aminogruppe. Deshalb nennt man die Aminosäuren in Peptiden und Eiweißen Aminosäurereste. Die entstandenen Peptidbindungen sind stabil und können erst durch Einwirkung starker Laugen und Säuren bei gleichzeitig hoher Temperatur gespalten werden.
Spaltung der Peptidbindung
Die Spaltung der Peptidbindung erfolgt durch die Hydrolyse des Peptids, bei der die gebildeten Peptidbindungen aufgebrochen und die einzelnen Aminosäuren wiederhergestellt werden. An dieser Reaktion ist Wasser beteiligt, dessen Moleküle in Hydroxylgruppen (-OH) und Wasserstoffatome (H) zerfallen, die sich dann mit den freigesetzten Bindungen der Substanz verbinden.
Peptidklassifikation
Die Klassifikation der Peptide erfolgt nach der Anzahl der Aminosäuren, aus denen sie bestehen. In der allgemeinen Peptidklassifikation unterscheiden wir:
-
Dipeptide – Produkte, die aus der Reaktion von zwei Aminosäuren entstehen, wobei eine Aminogruppe einer Aminosäure und eine Carboxylgruppe der anderen Aminosäure frei bleiben;
-
Oligopeptide – Peptide, die aus einigen bis zu einem Dutzend Aminosäuren bestehen;
-
Polypeptide – längere Peptide, die mehrere Dutzend Aminosäurereste enthalten;
-
Eiweiße – gelten als solche, wenn das Molekül aus mehr als hundert Aminosäureresten besteht.
Aktivitätsspektrum der Peptide
Peptide zeigen ein breites Spektrum biologischer Aktivität und werden zur Behandlung bakterieller Infektionen, Viruskrankheiten, Erkrankungen des Kreislaufsystems, des Knochensystems, des Nervensystems, Diabetes und Osteoporose eingesetzt.
Vorteile der Peptide
- Hohe Aktivität und Selektivität
- Breites Spektrum molekularer Ziele
- Potentiell geringere Giftigkeit im Vergleich zu niedermolekularen Verbindungen
- Geringe Anreicherung im Gewebe
- Hohe chemische und biologische Vielfalt
- Auf Genebene entdeckbar
- Einfache Synthese von Analoga
Peptidsynthese
Je nach gewünschtem Peptid benötigt man eine passende Synthesemethode. Kurz erklärt, stellen wir die Peptidsynthese in Bezug auf die Größe dar. Zur Herstellung eines Dipeptids wird ein Reagenz benötigt, das die Carboxylgruppe der acylierenden Aminosäure aktiviert, oder die acylierende Aminosäure wird in ein Anhydrid umgewandelt. Die Synthese größerer Peptide ist aufwändiger und schwieriger: Aus Dipeptiden wird durch Entfernen des Schutzes der Aminogruppe der N-terminalen Aminosäure und anschließendes Acylieren mit einer weiteren N-geschützten Aminosäure ein längerer Peptidstrang gebildet. Dieser Prozess ist besonders zeitintensiv, da die genannten Schritte wiederholt werden, bis die geplante Sequenz erreicht ist. Für die Herstellung großer Peptide ist die Merrifield-Methode am besten geeignet und am einfachsten. Diese Methode wird in der Festphasensynthese angewandt. Die C-terminale Aminosäure wird an ein Polymer gebunden, dann werden weitere Aminosäuren angefügt, bis die gewünschte Kettenlänge erreicht ist.
Biologisch aktive Peptide
Peptidhormone und Eiweißhormone kommen in unserer Umwelt häufig vor. Früher galten sie meist als wenig stabile Formen. Durch die Synthese kann man zunehmend gezielter eine Peptidtherapie auswählen, die dauerhaft und wirksam ist, je nach den Bedürfnissen des Körpers. Deshalb ist es wichtig, die Hormonstimulation geschickt und sicher zu steuern. Als Beispiel für biologisch aktive Peptide sei Glutathion genannt, ein Tripeptid mit spezifischer Struktur, das aus Glutaminsäure, Cystein und Glycin besteht. Glutaminsäure ist die N-terminale Aminosäure. Die Verbindung von Glutaminsäure mit Cystein ist jedoch untypisch für Peptide und Eiweiße, da hier nicht die α-Carboxylgruppe der Glutaminsäure, sondern die γ-Carboxylgruppe beteiligt ist. Glutathion liegt daher in reduzierter und oxidierter Form vor und heißt γ-Glutamylcysteinylglycin. In der reduzierten Form besitzt es eine freie Sulfhydrylgruppe, in der oxidierten Form werden zwei Wasserstoffatome von den –SH-Gruppen abgespalten. Die Schwefelatome bleiben wasserstofffrei, wodurch eine Disulfidbrücke entsteht. Die Modifikationsfähigkeit von Glutathion in oxidierter oder reduzierter Form ist wichtig bei Redoxprozessen.
Ein weiteres Beispiel sind Oxytocin und Vasopressin, Nanopeptide, die von Neuronen des Hypothalamus gebildet und vom Hinterlappen der Hirnanhangdrüse freigesetzt werden. Sie unterscheiden sich nur durch zwei Aminosäuren. Cystein kommt an zwei Positionen vor und führt so zur Bildung einer Disulfidbrücke. Oxytocin wirkt als Hormon, das die Kontraktionen der Gebärmutter anregt. Vasopressin fördert die Wasseraufnahme in den Nierentubuli. Vasopressin spielt auch eine wichtige Rolle bei der Regulation der Ausschüttung des adrenokortikotropen Hormons (ACTH) in Stresssituationen.
Peptidhormone
Adrenokortikotropes Hormon (ACTH)
Das adrenokortikotrope Hormon ist ein 39-Aminosäure-Peptid, das durch den Abbau eines viel größeren Vorläufermoleküls, der Proopiomelanocortin (POMC), entsteht. Proopiomelanocortin ist auch die Quelle anderer aktiver Peptide. Zwei Peptide sind in der Struktur von ACTH enthalten: das α-Melanotropin (α-MSH), das in den ersten 13 Aminosäuren von ACTH identisch ist, und das Peptid des intermediären Hypophysenteils, ähnlich der Kortikotropin-Fraktion 18-39 von ACTH. Die Hauptfunktion von ACTH besteht darin, die Nebennierenrinde so zu stimulieren, dass sie Steroidhormone ausschüttet. ACTH reguliert die Aktivität der Stratum fasciculatum und reticulare. Die biologische Aktivität von ACTH wird durch die ersten 18 Aminosäuren bestimmt. Die Regulation von ACTH erfolgt durch Corticoliberin (CRH), ein Hormon des Hypothalamus, das die Kortikotropinfreisetzung durch Cortisol mittels negativer Rückkopplung steuert. Das bedeutet, dass ein Cortisolmangel die Ausschüttung von CRH und ACTH anregt, während ein Überschuss diese hemmt. Durch die Freisetzung von Cortisol werden viele lebenswichtige Funktionen reguliert, z. B. die Mobilisierung des Körpers in Stresssituationen, Blutdrucksteigerung und entzündungshemmende Wirkungen. ACTH wird pulsartig im Tagesrhythmus ausgeschüttet, mit dem höchsten Spiegel am Morgen, wenn er am meisten benötigt wird, und sinkt im Laufe des Tages. Eine erhöhte ACTH-Ausschüttung wird bei Erkrankungen wie Nebennierenrindeninsuffizienz, Morbus Cushing oder Nelson-Syndrom beobachtet.
Insulin und C-Peptid
Insulin und C-Peptid werden in der Bauchspeicheldrüse des Menschen ständig produziert. Während der Insulinbiosynthese wird C-Peptid gebildet. Die Pankreaszellen produzieren zunächst Preproinsulin, das durch Abspaltung von Aminosäuren zu Proinsulin umgewandelt wird, das aus zwei Ketten, A und B, besteht, die durch das C-Peptid verbunden sind. Anschließend wird das C-Peptid von Proinsulin abgespalten, wodurch die endgültige Form entsteht. Bei Glukoseeintritt erhält die Bauchspeicheldrüse das Signal, Granula mit gespeicherten Insulin- und C-Peptidmolekülen freizusetzen. C-Peptid verbleibt in der Leber deutlich länger als Insulin, da es dort nicht abgebaut wird. Sein Abbau erfolgt hauptsächlich in den Nieren. Sowohl bei Insulin als auch bei C-Peptid führen erhöhte oder zu niedrige Werte zur Entwicklung von Diabetes Typ I oder II sowie Morbus Cushing. Schwankungen des C-Peptid-Spiegels können auch auf chronische Niereninsuffizienz oder das Vorhandensein von Metastasen oder lokalem Tumorrezidiv hinweisen, weshalb die Aufrechterhaltung normaler Werte so wichtig ist.
Motilin
Motilin ist ein Hormon, das mit der glatten Muskulatur von Magen und Darm verbunden ist und vom Nervus vagus gesteuert wird. Es wird in endokrinen Zellen synthetisiert. Als Peptidhormon, das aus 22 Aminosäuren in einer bestimmten Reihenfolge besteht, wird es von Zellen des Dünndarms produziert. Es wird von den endokrinen M-Zellen des Verdauungstrakts gebildet und reguliert die Motilität des Verdauungstrakts. Motilin ist ein wichtiges Hormon, das an der Entstehung der dritten Phase des wandernden motorischen Komplexes (MMC) beteiligt ist, in der Magen und Dünndarm den Magen von unnötigen Speiseresten und abgestoßenen Epithelzellen durch Anregung peristaltischer Bewegungen entleeren. Das Hormon beeinflusst außerdem die Entleerung der Gallenblase in der Verdauungspause bei maximaler Motilin-Konzentration.
Glukagon
Glukagon ist eines der Hormone, die an der Regulierung des Blutzuckerspiegels beteiligt sind. Dieses Peptid wird von endokrinen Zellen der Bauchspeicheldrüse ausgeschieden. Es ist ein Polypeptid aus 29 Aminosäuren, das aus einem 180 Aminosäuren umfassenden Vorläufer gebildet wird. Veränderungen des Blutzuckerspiegels führen zur Glukagonausschüttung. Die Produktion von Glukagon erfolgt in den Langerhans-Inseln, wo aus Proglukagon sowohl Glukagon als auch das glucagonähnliche pankreatische Peptid (GRPP) entstehen. Die Hauptaufgabe von Glukagon ist die Aufrechterhaltung eines normalen Blutzuckerspiegels im Serum bei Abfall zwischen den Mahlzeiten oder bei körperlicher Anstrengung. In solchen Situationen wird Glukagon aus der Leber freigesetzt, um den Körper zu schützen. Zusätzlich kann es die Nahrungsaufnahme regulieren, wodurch das Sättigungsgefühl früher eintritt. Glukagon kann möglicherweise die Freisetzung von Ghrelin hemmen und die Darmperistaltik bremsen.
Peptidanaloga
Peptidanaloga sind chemische Verbindungen, bei denen ein Atom im Vergleich zur Ausgangsverbindung durch ein anderes ersetzt wurde. Die Grundstruktur des Peptids bleibt unverändert. Zu den Peptidanaloga gehören Helixanaloga sowie β-Faltblatt- und β-Knickanaloga. Bei den Helixanaloga sind Helices ein Schlüsselelement der Struktur bioaktiver Peptide. Die Stabilisierung kurzer Oligomerfragmente in helikaler Konformation erhöht die Aktivität. Bei β-Faltblatt- und β-Knickanaloga werden D-Aminosäurereste oder β-, γ-, δ-Aminosäuren eingefügt. Peptidanaloga ermöglichen die Herstellung neuer, stabilerer Peptidverbindungen, die in einem breiteren Spektrum von Symptomen Anwendung finden und innovative Lösungen für Probleme bieten, die mit bisherigen Vorläuferformen verbunden sind.
Aussalzen von Peptiden
Der Aussalzungsprozess besteht in der Veränderung der Proteinladungen. Die Proteinladungen werden durch Anionen und Kationen der Salze neutralisiert. Die Proteinmoleküle ziehen sich nicht mehr an und bilden keine Aggregate, und das Protein fällt aufgrund des Verlusts der Wasserhülle aus. Der Aussalzungsprozess ist reversibel. Die Umkehr erfolgt durch Entfernung des Salzes mittels Dialyse oder durch Verdünnung durch Zugabe von Wasser. Basierend auf unseren früheren Artikeln kann man sagen, dass das Aussalzen, das zur Bildung der stabilen Form des Peptids BPC-157 führte, eine innovative Methode zur Sicherung der Peptidstabilität und damit zur Erweiterung der biologischen Wirkung von Peptiden ist.
Acetylierung von Peptiden
Die Acetylierung besteht in der Anlagerung von Acetylgruppen an Substrate, die Verbindungen mit NH2-, OH- oder SH-Gruppen sind, unter Beteiligung des Enzyms N-Acetyltransferase. Die Acetylgruppe stammt von Acetyl-CoA. Die Hauptfunktion der N-Acetyltransferasen ist die Erleichterung der Verbindung der Acetylgruppe mit der Aminogruppe aromatischer Amine und Hydrazine (N-Acetylierungsreaktion), also die Entgiftung potenziell toxischer exogener Verbindungen.
Amidierung von Peptiden
Wenn Peptidbindungen aufgebrochen werden und es zur Fragmentierung der Polypeptidkette kommt, entstehen Carbonylgruppen. Die Oxidation des Eiweißmoleküls durch Hydroxylradikale beginnt mit der Abspaltung eines Wasserstoffatoms am α-Kohlenstoff der Aminosäure. Das entstehende Alkylradikal reagiert mit Sauerstoff und bildet ein Alkylperoxylradikal, das zu Alkylhydroperoxid übergeht. Das daraus entstehende Alkoxylradikal kann sich in eine hydroxyliert am α-Kohlenstoff befindliche Aminosäurerest umwandeln oder zur Fragmentierung der Polypeptidkette führen. Das Vorhandensein des Alkoxylradikals begünstigt die Fragmentierung der Polypeptidkette. Die Spaltung der Peptidbindung kann durch α-Amidierung oder Diamidierung erfolgen. Bei der α-Amidfragmentierung besitzt das N-terminale Peptid am C-Ende eine Amidgruppe, während das andere Peptid am N-Ende eine N-α-Ketoacyl-Derivatgruppe enthält. Die Diamidfragmentierung ist durch die Bildung eines N-terminalen Peptids mit Diamidstruktur und eines Peptids vom C-Ende des Eiweißmoleküls mit einer Isocyanatstruktur am N-Ende gekennzeichnet.
Literatur 1. Murray R. K., Granner D. K., Mayes P. A., Rodwell V, Harper Biochemie. 1995; Medizinischer Verlag PZWL
2. Jakubke H. D., Jeschkeit H, Aminosäuren Peptide Eiweiße. 1982; Staatlicher Wissenschaftsverlag
3. Kołodziejczak A, Aminosäuren und Peptide. 2006





Auswirkung der BPC-157-Therapie auf das Immunsystem
Peptide mit antimikrobiellen Eigenschaften und ihre durch Modifikation entstandenen Analoga.