Parole chiave: peptide; idrolisi del peptide; legami peptidici; modifiche peptidiche, sintesi del peptide; legame peptidico; ormoni peptidici; analoghi peptidici; salificazione; amidazione; acetilazione
Peptidi
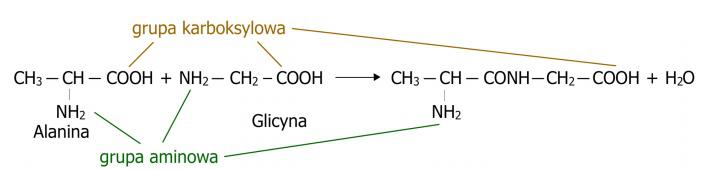
I peptidi sono composti chimici costruiti in modo simile alle proteine, a partire da amminoacidi. Si formano tramite l’unione di due o più amminoacidi mediante un legame peptidico a seguito di un processo di condensazione, nel quale, oltre al peptide, si forma anche una molecola d’acqua. (Fig.1) Sono oggetto di ampio interesse, svolgendo importanti funzioni biologiche. Molti ormoni e neurotrasmettitori sono proprio peptidi. Nel caso dei peptidi endogeni, essi agiscono contro i microrganismi, fungendo da sistema di difesa dell’organismo. I peptidi naturali e i loro analoghi sintetici sono considerati composti attraenti di rilevanza terapeutica grazie all’elevato grado di attività, bassa tossicità e assenza di interazioni con farmaci. In pratica medica, solo pochi peptidi trovano applicazione a causa della loro instabilità biologica e rapida degradazione, tuttavia la sintesi dei peptidi consente di ottenere forme stabili. Lo stesso vale, ad esempio, per la sintesi di peptidi da fonti naturali. I peptidi si presentano in forma lineare, possiedono solo due estremità specifiche. Una è chiamata estremità amminica, dove si trova l’amminoacido con il gruppo α-amminico libero. L’altra è detta estremità carbossilica o estremità C, dove si trova l’amminoacido con il gruppo α-carbossilico libero.
Denominazione dei peptidi
La denominazione dei peptidi inizia con il nome della residuo amminoacidico N-terminale, poi si elencano i nomi dei residui amminoacidici successivi e si conclude con il nome dell’amminoacido C-terminale. L’ordine degli amminoacidi viene scritto usando simboli a tre lettere o a una lettera.
Legame peptidico
Il carbonio, a seguito della reazione del gruppo α-carbossilico, si lega all’azoto del gruppo α-amminico tramite un legame singolo, il legame peptidico. Si ritiene che questo legame si formi in due strutture che rimangono in un equilibrio reciproco definito. Il legame C-N passa a C=N e viceversa. La rotazione attorno all’asse C=N non è possibile, per cui il legame peptidico è sufficientemente rigido da possedere caratteristiche di un legame doppio. Nel caso del legame peptidico che coinvolge il gruppo imino della prolina o idrossiprolina con il gruppo carbossilico di un altro amminoacido si forma una struttura diversa e distinta. L’azoto in questo caso è incorporato nella struttura dell’anello pirolidinico, non è presente il sostituente idrogeno e quindi non è possibile la rotazione attorno ai legami che coinvolgono l’azoto. Gli amminoacidi che partecipano alla formazione del legame peptidico perdono frammenti molecolari: sono molecole -OH dal gruppo carbossilico e -H dal gruppo amminico. Per questo motivo gli amminoacidi presenti nei peptidi e nelle proteine sono chiamati residui amminoacidici. I legami peptidici formati sono stabili e la loro rottura può avvenire solo sotto l’azione di basi e acidi forti a temperature elevate.
Rottura del legame peptidico
La rottura del legame peptidico avviene tramite la reazione di idrolisi del peptide, che consiste nella rottura dei legami peptidici formati e nel recupero dei singoli amminoacidi. In questa reazione è coinvolta l’acqua, le cui molecole si scindono in gruppi ossidrile (-OH) e atomi di idrogeno (H), che poi si legano ai legami liberati della sostanza.
Classificazione dei peptidi
La classificazione dei peptidi si basa sul numero di amminoacidi che li compongono. Nella classificazione generale dei peptidi distinguiamo:
-
Dipeptidi - prodotti che si formano dalla reazione di due amminoacidi mantenendo libero il gruppo amminico di uno e il gruppo carbossilico dell’altro;
-
Oligopeptidi - peptidi composti da alcune unità fino a una dozzina di amminoacidi;
-
Polipeptidi - peptidi più lunghi, contenenti diverse decine di residui amminoacidici;
-
Proteine – si considerano tali quando la molecola è composta da oltre cento residui amminoacidici.
Spettro di attività dei peptidi
I peptidi mostrano un ampio spettro di attività biologica e sono impiegati nel trattamento di infezioni batteriche, malattie virali, disturbi del sistema circolatorio, scheletrico, nervoso, diabete e osteoporosi.
Vantaggi dei peptidi
- Elevata attività e selettività
- Ampio spettro di bersagli molecolari
- Potenzialmente minore tossicità rispetto ai composti a basso peso molecolare
- Bassa accumulazione nei tessuti
- Elevata diversità chimica e biologica
- Possibilità di scoperta a livello genico
- Sintesi facile di analoghi
Sintesi dei peptidi
A seconda del peptide che si vuole ottenere, è necessaria la metodologia adeguata per la sua sintesi. In breve, cercheremo di presentare la sintesi dei peptidi in relazione alla loro dimensione. Per ottenere un dipeptide si deve utilizzare un reagente che attivi il gruppo carbossilico dell’amminoacido arilante o trasformare l’amminoacido acilante in anidride. La sintesi di peptidi più grandi, ottenuti a partire dal dipeptide, è un processo più laborioso e complesso, che prevede la rimozione della protezione del gruppo amminico dell’amminoacido N-terminale e la sua acilazione con un altro amminoacido N-protetto. Questo processo è particolarmente lungo, poiché le operazioni si ripetono fino a ottenere il peptide con la sequenza desiderata. Per la sintesi di peptidi di grandi dimensioni, il metodo più efficace e semplice è il metodo di Merrifield. Questo metodo si esegue in fase solida. L’amminoacido C-terminale viene fissato a un polimero e poi si aggiungono gli amminoacidi successivi fino a raggiungere la lunghezza della catena desiderata.
Peptidi biologicamente attivi
Gli ormoni peptidici e proteici sono ampiamente presenti nell’ambiente che ci circonda. In passato erano noti soprattutto come forme poco stabili. Grazie alla sintesi, è possibile selezionare terapie peptidiche sempre più efficaci e durature, adattate alle esigenze dell’organismo. Per questo è importante saper modulare in modo sicuro la stimolazione ormonale. Tra i peptidi biologicamente attivi possiamo citare il glutatione, un tripeptide con struttura specifica composto da glutammato, cisteina e glicina. Il glutammato è l’amminoacido N-terminale. La connessione tra glutammato e cisteina è però atipica per peptidi e proteine, poiché non è presente il gruppo α-carbossilico del glutammato, ma il gruppo γ-carbossilico. Il glutatione si presenta quindi in forma ridotta e ossidata, essendo γ-glutamilcisteinilglicina. Nella forma ridotta possiede un gruppo solfidrilico libero, mentre nella forma ossidata avviene la rimozione di una coppia di atomi di idrogeno dai gruppi –SH. Gli atomi di zolfo rimangono privi di idrogeno, formando un ponte disolfuro. La capacità del glutatione di modificarsi tra forma ossidata e ridotta è importante nei processi ossido-riduttivi.
Un altro esempio sono l’ossitocina e la vasopressina, nanopeptidi prodotti dai neuroni dell’ipotalamo e rilasciati dalla parte posteriore dell’ipofisi, che differiscono solo per due amminoacidi. La cisteina è presente in due posizioni, permettendo la formazione di un ponte disolfuro. L’ossitocina agisce come ormone stimolante le contrazioni uterine. La vasopressina stimola invece il riassorbimento dell’acqua nei tubuli renali. La vasopressina ha anche un ruolo importante nella regolazione del rilascio dell’ormone adrenocorticotropo (ACTH) in situazioni di stress.
Ormoni peptidici
Ormone adrenocorticotropo (ACTH)
L’ormone adrenocorticotropo, un peptide di 39 amminoacidi, si forma dalla degradazione di una molecola precursore molto più grande, la pro-opiomelanocortina (POMC). La pro-opiomelanocortina è anche fonte di altri peptidi attivi. Due peptidi sono contenuti nella struttura dell’ACTH: l’ormone α-melanotropo (α-MSH), identico ai primi 13 amminoacidi dell’ACTH, e il peptide della parte intermedia dell’ipofisi simile alla corticotropina, frammento 18-39 dell’ACTH. La funzione principale dell’ACTH è stimolare la corteccia surrenale affinché produca ormoni steroidei. L’ACTH regola l’attività degli strati fascicolato e reticolato della corteccia. L’attività biologica dell’ACTH è attribuita ai primi 18 amminoacidi. La regolazione dell’ACTH avviene tramite la corticoliberina (CRH), ormone prodotto nell’ipotalamo, che stimola il rilascio di corticotropina, e tramite il cortisolo con un meccanismo di retroazione negativa. Ciò significa che la carenza di cortisolo stimola CRH e ACTH, mentre un eccesso ne inibisce la secrezione. Il rilascio di cortisolo regola molte funzioni vitali, tra cui la mobilitazione dell’organismo in condizioni di stress, l’aumento della pressione sanguigna e le capacità antinfiammatorie. L’ACTH viene secreto in modo pulsatile con ritmo circadiano, con concentrazioni massime al mattino, quando è più necessario, e poi decresce durante la giornata. L’aumento della secrezione di ACTH si osserva in condizioni patologiche come insufficienza corticosurrenalica, morbo di Cushing e sindrome di Nelson.
Insulina e peptide C
Insulina e peptide C sono prodotti continuamente nel pancreas umano. Durante la biosintesi dell’insulina, viene prodotto anche il peptide C. Le cellule pancreatiche producono inizialmente la preproinsulina, che subisce modifiche successive con la rimozione di amminoacidi, portando alla formazione della proinsulina composta da due catene, A e B, unite dal peptide C. Successivamente il peptide C viene rimosso dalla proinsulina, formando la forma finale dell’insulina. Quando il glucosio entra nell’organismo, il pancreas riceve il segnale per rilasciare le granuli contenenti insulina e peptide C. Il peptide C rimane nel fegato molto più a lungo dell’insulina, poiché non viene degradato lì, ma principalmente nei reni. Livelli troppo alti o troppo bassi di insulina e peptide C possono portare allo sviluppo del diabete di tipo I o II e alla malattia di Cushing. Le variazioni del peptide C possono anche indicare insufficienza renale cronica o la presenza di metastasi o recidive tumorali locali, perciò è importante mantenere i livelli normali.
Motilina
La motilina è un ormone legato ai muscoli lisci dello stomaco e dell’intestino, controllato dalle fibre del nervo vago. È sintetizzata nelle cellule endocrine. Come ormone peptidico, formato da 22 amminoacidi in una sequenza specifica, è prodotto dalle cellule dell’intestino tenue. Prodotta dalle cellule endocrine del sistema digerente M (Mo), partecipa alla regolazione della motilità del tratto gastrointestinale. La motilina è un ormone importante nella formazione della terza fase del complesso motorio migrante (MMC), durante la quale stomaco e intestino tenue svuotano lo stomaco da residui alimentari inutili e cellule epiteliali desquamate, stimolando i movimenti peristaltici. L’ormone influisce anche sullo svuotamento della cistifellea nel periodo interdigestivo, quando la concentrazione di motilina è massima.
Glucagone
Il glucagone è uno degli ormoni coinvolti nella regolazione della concentrazione di glucosio. Questo peptide è secreto dalle cellule endocrine del pancreas. È un polipeptide composto da 29 amminoacidi, derivato da un precursore di 180 amminoacidi. Le variazioni della concentrazione di glucosio stimolano la secrezione di glucagone. L’ormone viene prodotto nelle isole pancreatiche, dove dal proglucagone si formano sia il glucagone sia il polipeptide pancreatico glicentinodipendente (GRPP). Il compito principale del glucagone è mantenere la concentrazione corretta di glucosio nel siero durante i cali tra i pasti o durante l’attività fisica. In queste situazioni le riserve di glucagone vengono rilasciate dal fegato per proteggere l’organismo. Inoltre, può partecipare alla regolazione dell’assunzione di cibo, anticipando il senso di sazietà. Il glucagone può anche inibire il rilascio della grelina e rallentare la peristalsi intestinale.
Analoghi peptidici
Gli analoghi peptidici sono composti chimici in cui un atomo è sostituito da un altro rispetto al composto originale. La struttura generale del peptide rimane invariata. Tra gli analoghi peptidici vi sono quelli con struttura ad elica e quelli con pieghe β e foglietti β. Nel primo caso, le eliche sono uno degli elementi strutturali chiave dei peptidi bioattivi. La stabilizzazione di brevi frammenti oligomerici in conformazione elicoidale aumenta l’attività. Negli analoghi con pieghe β e foglietti β si inseriscono residui di D-amminoacidi o amminoacidi β, γ, δ. Gli analoghi peptidici permettono di ottenere nuovi composti peptidici più stabili, con applicazioni in un più ampio spettro di sintomi e consentono soluzioni innovative a problemi legati all’azione delle forme precedenti.
Salificazione dei peptidi
Il processo di salificazione consiste nella modifica delle cariche proteiche. Le cariche della proteina vengono neutralizzate da anioni e cationi del sale. Le molecole proteiche non si attraggono e non formano aggregati, e la proteina precipita a causa della perdita del mantello acquoso. Il processo di salificazione è reversibile. Nel processo inverso il sale viene rimosso tramite dialisi o la sua concentrazione viene ridotta aggiungendo acqua. Basandoci sui nostri precedenti articoli, possiamo affermare che la salificazione che ha portato alla formazione della forma stabile del peptide BPC-157 è un metodo innovativo per garantire la stabilità peptidica e quindi ampliare l’azione biologica dei peptidi.
Acetilazione dei peptidi
L’acetilazione consiste nell’aggiunta di gruppi acetile ai substrati, che sono composti con gruppi NH2, OH o SH, con l’ausilio dell’enzima N-acetiltransferasi. La fonte del gruppo acetile è l’acetil-CoA. La funzione principale delle N-acetiltransferasi è facilitare il legame del gruppo acetile con il gruppo amminico degli amminoacidi aromatici e delle idrazine (reazione di N-acetilazione), cioè la detossificazione di composti esogeni potenzialmente tossici.
Amidazione dei peptidi
Quando si rompono i legami peptidici e di conseguenza si frammenta la catena polipeptidica, si formano gruppi carbonilici. L’ossidazione della molecola proteica da parte del radicale ossidrile inizia con la rimozione di un atomo di idrogeno dal carbonio α dell’amminoacido. Il radicale alchilico che si forma reagisce con l’ossigeno formando un radicale alchilperossido che si trasforma in alchilidroperossido. Il radicale alchossilico che si forma può trasformarsi in un residuo amminoacidico idrossilato al carbonio α oppure può causare la frammentazione della catena polipeptidica. La presenza del radicale alchossilico favorisce la frammentazione della catena polipeptidica. La scissione del legame peptidico può avvenire tramite α-amidazione o diamidazione. Durante la frammentazione α-amidica, il peptide N-terminale ha un gruppo ammidico al C-terminale, mentre l’altro peptide contiene al N-terminale un derivato N-α-chetoacilico. La frammentazione diamidica è caratterizzata dalla formazione di un peptide N-terminale con struttura diamidica e di un peptide proveniente dal C-terminale della proteina con struttura isocianica al N-terminale.
Bibliografia 1.Murray R. K., Granner D. K., Mayes P. A., Rodwell V, Biochimica di Harper. 1995; Casa Editrice Medica PZWL
2.Jakubke H. D., Jeschkeit H, Amminoacidi peptidi proteine. 1982; Casa Editrice Statale Scientifica
3.Kołodziejczak A, Amminoacidi e peptidi. 2006





Effetto della terapia BPC-157 sul sistema immunitario
Peptidi con proprietà antimicrobiche e i loro analoghi ottenuti mediante modifiche.