Aminosäuren mit unterschiedlicher Kettenlänge und unterschiedlicher Sequenz können Dimere und Polymere bilden. Je nach Anzahl der Aminosäurereste, die sich auf der Polymerkette befinden, werden Polymere in Peptide und Proteine unterteilt. Peptide enthalten in ihrer Struktur etwa 50 Aminosäuren, und Proteine enthalten in einer oder mehreren Ketten eine größere Anzahl von Aminosäureresten als Peptide. Sowohl Aminosäuren, Proteine als auch Peptide spielen eine wichtige Rolle für das ordnungsgemäße Funktionieren des Organismus. Dank moderner Peptidtherapien kann die Regeneration des Organismus ermöglicht werden.
Schlüsselwörter: Peptid · Aminosäure · Protein · α-Helix · β-Struktur · unpolare Kette · Alanin · Valin · Leucin · Isoleucin · Phenylalanin · Tryptophan · Methionin · Prolin · Glycin · Serin · Threonin · Tyrosin · Cystein · Asparagin · Glutamin · Asparaginsäure · Glutaminsäure · Konfiguration · Konformation · Dipeptid · Oligopeptid · Peptidbindung · Wachstumshormon
Abkürzungsverzeichnis: ACTH – Adrenokortikotropin; CRH – Kortikoliberin; POMC – Proopiomelanocortin; MMC – wandernder motorischer Komplex; GRPP – glicentin-abhängiges pankreatisches Polypeptid; HGH – Wachstumshormon Die biologische Rolle von Aminosäuren, Proteinen und Peptiden bei der ordnungsgemäßen Funktion und Regeneration des Körpers, dargestellt wie folgt, ermöglicht ein Verständnis ihrer Wirkungsweise und der Möglichkeiten, die sie bieten.
Charakteristik der Aminosäuren
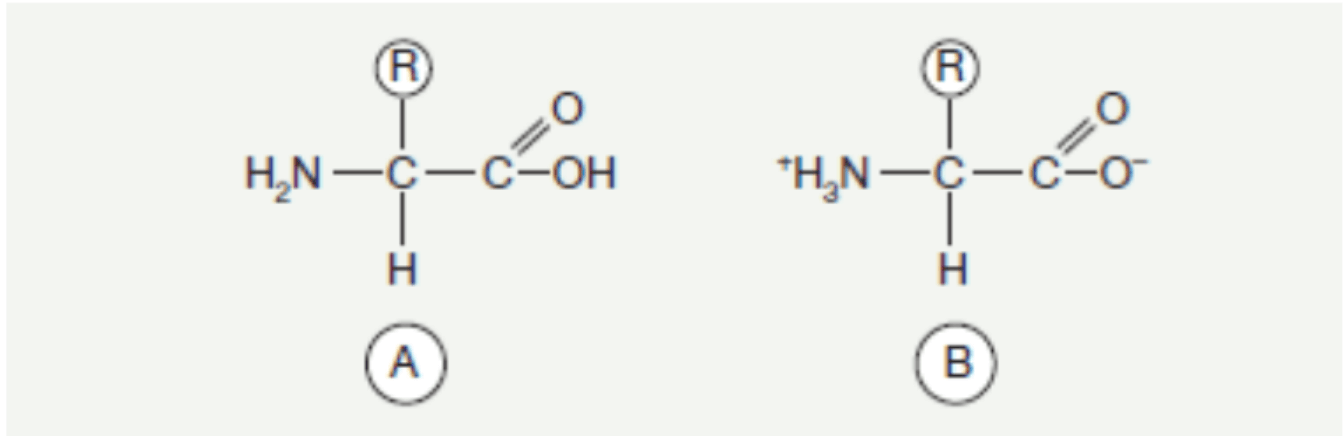
Aminosäuren, als eine der am besten erforschten Bestandteile lebender Organismen, treten als Derivate organischer Säuren auf, bei denen mindestens ein Wasserstoffatom durch eine Aminogruppe ersetzt ist. Sie kommen sowohl in freier Form als auch gebunden – im Fall von Peptiden oder Proteinen – vor. Jede Aminosäure, die in Proteinen vorkommt, mit Ausnahme von Prolin und Hydroxyprolin, besitzt eine Aminogruppe am α-Kohlenstoff und eine Seitenkette R, die unterschiedliche Strukturen haben kann und über denselben Kohlenstoffatom verbunden ist.
Allgemeine Formel der Aminosäure.
A. In freier Form
B. In Form eines Zwitterions. In der Umwelt sind etwa 300 Aminosäuren bekannt, jedoch kommen davon 22 häufig vor, von denen 2 zusätzliche relativ kürzlich entdeckt wurden und nur in bestimmten Proteinen vorkommen. Über die Anwesenheit und Position in der Proteinstruktur der bereits bekannten Aminosäuren entscheiden genetische Eigenschaften; in einigen Fällen ist dies das Ergebnis posttranslationaler Modifikationen der Aminosäurereste, die zuvor in die Proteinkette eingebaut wurden. Andere Aminosäuren können in freier Form oder in nicht-proteinogenen Verbindungen vorkommen. Die Rolle einer Aminosäure im Protein wird durch die Struktur ihrer Seitenkette bestimmt, weshalb die Einteilung der Aminosäuren in mehrere Gruppen erfolgt, abhängig vom Charakter der Seitenketten.
Aminosäuren mit unpolaren Seitenketten
Zu den Aminosäuregruppen mit unpolaren Seitenketten gehören nacheinander: Alanin, Valin, Leucin, Isoleucin, Phenylalanin, Tryptophan, Methionin, Prolin und Glycin. Bei den beiden zuletzt genannten Aminosäuren besteht eine gewisse Abhängigkeit. Prolin ist ein untypisches Beispiel, da es keine α-Aminogruppe besitzt, sondern eine Iminogruppe, die in die Struktur des Pyrrolidinrings eingebaut ist. Die biologische Rolle von Aminosäuren, Proteinen und Peptiden bei der ordnungsgemäßen Funktion und Regeneration des Körpers Glycin besitzt hingegen keine Seitenkette, sondern an deren Stelle ein Wasserstoffatom. Jede der genannten Aminosäuren hat eine unpolare Seitenkette, die keine Fähigkeit besitzt, Protonen aufzunehmen oder abzugeben, und nicht an der Bildung von Wasserstoff- oder Ionenbindungen beteiligt ist. Die Seitenkette wird meist als lipophil, also hydrophob – wasserabweisend – betrachtet. Solche Ketten meiden wässrige Umgebungen, indem sie aneinander haften und zum Inneren des Proteinmoleküls gerichtet sind. Befinden sie sich in einer wässrigen Umgebung, lässt sich ihr Verhalten am besten mit dem von Öltröpfchen vergleichen, die sich zu größeren Tropfen verbinden und so den Kontakt mit Wasser verringern.
Aminosäuren mit polaren, ungeladenen Seitenketten
Zur Gruppe der Aminosäuren mit polaren, ungeladenen Seitenketten gehören: Serin, Threonin, Tyrosin, Cystein, Asparagin und Glutamin. Diese Aminosäuren tragen bei neutralem pH keine Ladung, jedoch können Cystein und Tyrosin bei basischem pH ein Proton verlieren. Serin, Threonin und Tyrosin sind aufgrund ihrer polaren Hydroxylgruppe in der Lage, Wasserstoffbrückenbindungen zu bilden. Auch bei den Seitenketten von Asparagin und Glutamin können aufgrund der Carbonyl- und Amidgruppen Wasserstoffbrückenbindungen entstehen. Die Amidgruppe von Asparagin sowie die Hydroxylgruppen von Serin und Threonin können Bindungsstellen für Zuckerbestandteile sein. Die biologische Rolle von Aminosäuren, Proteinen und Peptiden bei der richtigen Funktion und Regeneration des Körpers.
Aminosäuren mit sauren Seitenketten
Zur Gruppe der Aminosäuren mit sauren Seitenketten gehören Asparaginsäure und Glutaminsäure. In den Seitenketten dieser Aminosäuren sind Carboxylgruppen sichtbar. Bei neutralem pH werden diese vollständig dissoziiert und tragen eine negative Ladung. Die vollständig ionisierten Formen der Asparaginsäure und Glutaminsäure nennen wir Asparaginat und Glutamat. Die entstandenen, umgewandelten Namen nach der Ionisierung zeigen, dass sie bei physiologischem pH Anionen sind. Die biologische Rolle von Aminosäuren, Proteinen und Peptiden bei der richtigen Funktion und Regeneration des Körpers
Aminosäuren mit basischen Seitenketten
Aminosäuren mit basischen Seitenketten. Zur Gruppe der Aminosäuren mit basischen Seitenketten gehören: Lysin, Arginin und Histidin. Die Seitenketten dieser Aminosäuren enthalten Gruppen, die Protonen binden können. Zu diesen Gruppen gehören die ε-Aminogruppe des Lysin, die Guanidingruppe des Arginin und der Imidazolring des Histidin. Bei physiologischem pH sind die R-Gruppen von Lysin und Arginin vollständig ionisiert, wodurch sie eine positive Ladung erhalten. Die freie Aminosäure Histidin hat einen leicht basischen Charakter und liegt bei physiologischem pH in neutraler Form vor. Es kann jedoch vorkommen, dass Histidin in einem Protein eine R-Gruppe besitzt, die je nach Umgebung des Proteins positiv geladen oder neutral ist. Dies spielt eine wichtige Rolle für die Funktion des Proteins Hämoglobin.
Proteine
Charakteristik der Proteine
Proteine als Kondensationspolymere von Aminosäuren, die zahlreich im menschlichen Körper vorkommen, sind die grundlegenden strukturellen Bestandteile für dessen ordnungsgemäße Funktion. Proteine, die ausschließlich aus Aminosäureresten bestehen, werden als einfache Proteine oder Proteine bezeichnet. Komplexe Proteine, Proteide, enthalten zusätzlich eine prosthetische Gruppe, die kein Proteinbestandteil ist. Als makromolekulare Produkte entstehen sie durch die Interaktion der α-Carboxylgruppe einer Aminosäure mit der α-Aminogruppe einer anderen Aminosäure und bilden eine Peptidbindung. Polypeptide nennen wir Proteine, deren Molekulargewicht größer als 10.000 Dalton (Da) ist. Alle Proteine mit einem geringeren Molekulargewicht bezeichnen wir als Oligopeptide. Jedes Protein besitzt eine Proteinkette, die aus 100 bis 1000 Aminosäureresten besteht.
Primärstruktur
Die Primärstruktur der Polypeptidkette eines bestimmten Proteins bestimmt die Reihenfolge (Sequenz) der Aminosäurereste in der Polypeptidkette. Die einzelnen Aminosäuren sind kovalent durch Peptidbindungen verbunden. In Proteinen kommen nur bestimmte Aminosäuresequenzen vor, aufgrund der großen Kombinationsmöglichkeiten. Die Anordnung der Aminosäurereste entlang der Polypeptidkette ist nicht streng und klar definiert. Am Beispiel des Proteins Hämoglobin kann die Bedeutung der Primärstruktur hervorgehoben werden. In diesem Fall führt der Ersatz einer Aminosäure durch eine andere zur Entstehung eines pathologischen Hämoglobins. Um das Wesen seiner Entstehung besser zu verstehen, wird beispielhaft an der sechsten Position Glutaminsäure durch eine andere Aminosäure (Valin oder Lysin) ersetzt, was zu negativen biologischen Folgen führt. Die roten Blutkörperchen verändern sich biologisch und nehmen eine untypische Form an. Die Zellen werden anfällig für Hämolyse, was gleichzeitig zu einer Verringerung der Anzahl der Erythrozyten im Blut führt. Die Abbauprodukte der Erythrozyten werden von Leber und Milz aufgenommen, und die Konzentration des Gallenfarbstoffs, also Bilirubin, steigt infolge des Abbaus des Häms im Hämoglobin an. Die Folge dieser Prozesse ist die Entwicklung einer Erkrankung, der hämolytischen Anämie.
Sekundärstruktur
Wenn man über die Sekundärstruktur spricht, sind die grundlegenden Begriffe Konfiguration und Konformation. Während sich die Konfiguration auf die geometrischen Verbindungen zwischen bestimmten Atomgruppen bezieht, betrifft die Konformation die räumliche Struktur des Proteins. Bei der Konfiguration kommt es zu einer gegenseitigen Veränderung der bereits entstandenen Verbindungen, zum Beispiel die Umwandlung von D-Alanin in L-Arginin. Eine solche Konversion kann durch das Brechen vorhandener kovalenter Bindungen und deren Neubildung erreicht werden. Die Konformation führt hingegen nicht zum Bruch kovalenter Bindungen, sondern zum Brechen und Wiederbilden nichtkovalenter Kräfte, also Wasserstoffbrücken oder hydrophobe Wechselwirkungen. Biologische Bedeutung haben nur einige der entstandenen Konformationen. Die am häufigsten vorkommende Form der Sekundärstruktur eines Proteins ist die α-Helix in Spiralform. Auf eine Umdrehung der α-Helix entfallen 3,6 Aminosäurereste. Die biologische Rolle von Aminosäuren, Proteinen und Peptiden im korrekten Funktionieren und der Regeneration des Organismus. Die spezifische und von anderen abweichende Spiralform ermöglicht die Bildung von Wasserstoffbrücken, sowohl innerhalb der Kette als auch zwischen den Windungen, mit maximaler Stärke aufgrund der Möglichkeit elektrostatischer Wechselwirkungen. Die Struktur der α-Helix, die die Peptidbindung der Protein-Kette umfasst, erlaubt deren Beteiligung an der Bildung von Wasserstoffbrücken, mit Ausnahme der Bindungen, an denen die Iminogruppen der Prolin beteiligt sind. Polypeptide, die durch Synthese aus L-Aminosäuren oder D-Aminosäuren erhalten wurden, bilden spontan die Struktur der α-Helix. Polypeptide, die aus Aminosäureracematen sowie Polymere bestimmter Aminosäuren wie Prolin oder Hydroxyprolin entstanden sind, besitzen nicht die Fähigkeit, diese Struktur spontan zu bilden. Zum Beispiel α-Keratin, ein Protein, das unter anderem in Haaren vorkommt und nahezu vollständig die Struktur der α-Helix aufweist, während Kollagen oder Elastin, in denen Prolin und Hydroxyprolin vorkommen, keine Fähigkeit besitzen, diese Struktur zu bilden.
Tertiärstruktur
Die Tertiärstruktur ermöglicht die Erhaltung der Sekundärstruktur bei der dreidimensionalen Faltung des Proteinmoleküls. Die biologische Rolle von Aminosäuren, Proteinen und Peptiden bei der richtigen Funktion und Regeneration des Organismus 7 Für die räumliche Anordnung des Proteinmoleküls ist hauptsächlich die Primärstruktur verantwortlich, indirekt auch die Sekundärstruktur. Die Tertiärstruktur wird durch Wechselwirkungen zwischen den Seitenketten der Aminosäurereste stabilisiert, im Falle kovalenter Bindungen, darunter Wasserstoffbrücken, sowie durch nichtkovalente Bindungen mit niedriger Energie, also Wasserstoffbindungen. In wässrigen Lösungen ist die Struktur globulärer Proteine kompakt. Hydrophobe Seitenketten der Aminosäurereste sind im Inneren des Moleküls verborgen, während hydrophile Gruppen an der Oberfläche des Moleküls liegen. Polare Gruppen, einschließlich der im Inneren des Moleküls verborgenen, zusammen mit den Bestandteilen der Peptidbindungen, ermöglichen die Bildung von Wasserstoffbrücken sowie elektrostatischen Wechselwirkungen. Die Tertiärstruktur entsteht nur dann, wenn Bindungen vorhanden sind, die eine Verbindung von linear weit auseinanderliegenden Aminosäureresten erlauben.
Quartärstruktur
Die zuletzt dargestellte Struktur kommt nur in einigen Proteinen vor und bestimmt die räumliche Anordnung sowie die Untereinheitenzusammensetzung in Bezug auf ein einzelnes Proteinmolekül. Proteine besitzen in diesem Fall eine hohe Molekularmasse und bestehen aus zwei oder mehr Monomeren, also Peptidketten. Üblicherweise sind bei der quartären Struktur die an ihrer Bildung beteiligten Proteinbestandteile durch Wasserstoffbrücken mit geringer Energie verbunden. In einigen Fällen wird die Struktur durch Disulfidbrücken zwischen Cysteinresten stabilisiert. Bei Kollagen und Elastin sind die kovalenten Bindungen zwischen den Untereinheiten besonders stabil. Die biologischen Eigenschaften der quartären Struktur können durch niedermolekulare Substanzen, sogenannte allosterische Effektoren, modifiziert werden. Bei Hämoglobin und enzymatischen Proteinen, insbesondere der Laktatdehydrogenase, ist die quartäre Struktur sehr gut erforscht. Die biologische Rolle von Aminosäuren, Proteinen und Peptiden bei der normalen Funktion und Regeneration des Körpers.
Peptide
Charakteristik von Peptiden
Peptide sind chemische Verbindungen, die ähnlich wie Proteine aus Aminosäuren aufgebaut sind. Sie sind Gegenstand großen Interesses und erfüllen wichtige biologische Funktionen. Viele Hormone sowie Neurotransmitter sind tatsächlich Peptide. Im Fall endogener Peptide wirken sie antimikrobiell und fungieren als Abwehrsystem des Körpers. Natürlich vorkommende Peptide und ihre synthetischen Analoga gelten aufgrund ihrer hohen Aktivität, niedrigen Toxizität und fehlenden Wechselwirkungen mit Medikamenten als attraktive Verbindungen mit therapeutischer Bedeutung. In der medizinischen Praxis finden nur wenige Peptide Anwendung, da sie biologisch instabil sind und schnell abgebaut werden, doch die Peptidsynthese ermöglicht die Herstellung stabiler Formen. Ähnlich verhält es sich beispielsweise bei der Synthese von Peptiden aus natürlichen Quellen, die unter anderem zur Herstellung von Impfstoffen verwendet werden. Das Produkt, das aus der Reaktion zweier Aminosäuren entsteht, wird Dipeptid genannt, wobei eine freie Aminogruppe einer Aminosäure und eine freie Carboxylgruppe der anderen Aminosäure erhalten bleiben. Peptide, die aus einigen bis zu einem Dutzend Aminosäuren bestehen, werden Oligopeptide genannt, während längere Peptide mit mehreren Dutzend Aminosäureresten Polypeptide genannt werden. Die Benennung von Peptiden beginnt mit dem Namen der Aminosäurerest am N-terminalen Ende, gefolgt von den Namen der weiteren Aminosäurereste und endet mit dem Namen der Aminosäure am C-terminalen Ende. Die Reihenfolge der Aminosäuren wird mit dreibuchstabigen oder einbuchstabigen Symbolen angegeben. Peptide liegen in unverzweigter Form vor und besitzen nur zwei spezifische Enden. Eines davon wird Aminoende genannt, an dem sich eine Aminosäure mit freier α-Aminogruppe befindet. Das andere wird Carboxylende oder C-Ende genannt, an dem sich eine Aminosäure mit freier α-Carboxylgruppe befindet.
Peptidbindung
Das Kohlenstoffatom bindet sich infolge der Reaktion der α-Carboxylgruppe mit dem Stickstoff der α-Aminogruppe durch eine Einfachbindung, die Peptidbindung. Es wird angenommen, dass diese Bindung in Form von zwei Strukturen entsteht, die in einem bestimmten, gegenseitigen Gleichgewicht stehen. Die C-N-Bindung wechselt zwischen C=N und umgekehrt. Eine Rotation um die C=N-Achse ist nicht möglich, wodurch die Peptidbindung so starr ist, dass sie Eigenschaften einer Doppelbindung besitzt. Die biologische Rolle von Aminosäuren, Proteinen und Peptiden bei der ordnungsgemäßen Funktion und Regeneration des Körpers 9 Im Fall der Peptidbindung unter Beteiligung der Iminogruppe von Prolin oder Hydroxyprolin mit der Carboxylgruppe einer anderen Aminosäure entsteht eine andere, eigenständige Struktur. Der Stickstoff ist in diesem Fall in die Pyrrolidinringstruktur eingebaut, es gibt keinen Wasserstoffsubstituenten, wodurch keine Rotation um die Bindungen möglich ist, die in Anwesenheit von Stickstoff entstehen. Aminosäuren, die an der Bildung der Peptidbindung beteiligt sind, verlieren Molekülfragmente. Dies sind -OH-Gruppen aus der Carboxylgruppe und -H-Gruppen aus der Aminogruppe. Deshalb nennen wir die Aminosäuren, die in Peptiden und Proteinen vorkommen, Aminosäurereste. Die entstandenen Peptidbindungen sind stabil und können erst unter Einwirkung starker Basen und Säuren bei gleichzeitig hoher Temperatur gespalten werden.
Biologisch aktive Peptide
Peptidhormone und Proteinhormone sind in unserer Umgebung weit verbreitet. Früher waren sie größtenteils als wenig stabile Formen bekannt. Durch die Synthese kann man zunehmend mutiger eine Peptidtherapie auswählen, die je nach den Bedürfnissen des Körpers dauerhaft und wirksam ist. Deshalb lohnt es sich, geschickt und sicher mit der Stimulation von Hormonen zu experimentieren. Unter Berücksichtigung einiger biologisch aktiver Peptide können wir zum Beispiel Glutathion anführen, das als Tripeptid mit einer spezifischen Struktur aus Glutaminsäure, Cystein und Glycin aufgebaut ist. Glutaminsäure tritt als N-terminaler Aminosäurerest auf. Die Verbindung von Glutaminsäure mit Cystein ist jedoch für Peptide und Proteine untypisch, da hier nicht die α-Carboxylgruppe der Glutaminsäure, sondern die γ-Carboxylgruppe beteiligt ist. Glutathion liegt daher in reduzierter und oxidierter Form vor und heißt γ-Glutamylcysteinylglycin. In der reduzierten Form besitzt es eine freie Sulfhydrylgruppe, während in der oxidierten Form ein Wasserstoffpaar von den –SH-Gruppen abgespalten wird. Die Schwefelatome bleiben dabei wasserstofffrei, was zur Bildung einer Disulfidbrücke führt. Die modifizierende Fähigkeit von Glutathion in oxidiertem oder reduziertem Zustand ist bei Redoxprozessen von Bedeutung. Ein weiteres Beispiel sind Oxytocin und Vasopressin, die als Nanopeptide von Neuronen des Hypothalamus produziert und vom Hinterlappen der Hirnanhangsdrüse freigesetzt werden und sich nur in zwei Aminosäuren unterscheiden. Cystein tritt an zwei Positionen auf, was zur Bildung einer Disulfidbrücke führt. Oxytocin wirkt als Hormon, das die Kontraktionsaktivität der Gebärmutter stimuliert. Vasopressin hingegen fördert die Wasseraufnahme in den Nierentubuli. Vasopressin spielt auch eine wichtige Rolle bei der Regulation der Ausschüttung des adrenokortikotropen Hormons (ACTH) in Stresssituationen. Die biologische Rolle von Aminosäuren, Proteinen und Peptiden bei der richtigen Funktion und Regeneration des Körpers.
Peptidhormone
Adrenokortikotropes Hormon (ACTH)
Das adrenokortikotrope Hormon (ACTH) ist ein 39-Aminosäure-Peptid, das durch den Abbau eines viel größeren Vorläufermoleküls, der Proopiomelanocortin (POMC), entsteht. Proopiomelanocortin dient auch als Quelle für andere aktive Peptide. Zwei Peptide sind in der Struktur von ACTH enthalten. Dazu gehören das α-Melanotropin-Hormon (α-MSH), das in seiner Struktur mit den ersten 13 Aminosäuren von ACTH identisch ist, und das Peptid des intermediären Hypophysenteils, ähnlich der Kortikotropin-Fragmente 18-39 von ACTH. Die Hauptfunktion von ACTH besteht darin, die Nebennierenrinde so zu stimulieren, dass sie in der Lage ist, Steroidhormone zu produzieren. Das adrenokortikotrope Hormon reguliert die Aktivität auf der Ebene der Stratum fasciculatum und reticulatum. Für die biologische Aktivität von ACTH sind die ersten 18 Aminosäuren verantwortlich. Die Regulation von ACTH erfolgt durch Corticoliberin (CRH), ein Hormon, das im Hypothalamus vorkommt und die Kortikotropinfreisetzung durch Cortisol mittels negativer Rückkopplung steuert. Das bedeutet, dass ein Cortisolmangel die Stimulation von CRH und ACTH bewirkt, während ein Überschuss deren Ausschüttung hemmt. Durch die Freisetzung von Cortisol werden viele lebenswichtige Funktionen reguliert, darunter die Mobilisierung des Körpers unter Stressbedingungen, die Erhöhung des Blutdrucks und entzündungshemmende Fähigkeiten. ACTH wird pulsartig im Tagesrhythmus ausgeschüttet, wobei die höchste Konzentration morgens beobachtet wird, wenn sie am meisten benötigt wird, und im Laufe des Tages abnimmt. Eine erhöhte ACTH-Ausschüttung wird bei Erkrankungen wie Nebennierenrindeninsuffizienz, Cushing-Krankheit oder Nelson-Syndrom beobachtet.
Insulin und C-Peptid
Insulin und C-Peptid werden in der Bauchspeicheldrüse ständig vom menschlichen Körper ausgeschüttet. Während der Insulinproduktion, im Prozess ihrer Biosynthese, wird C-Peptid produziert. Die Pankreaszellen produzieren im ersten Schritt Preproinsulin, das durch Abspaltung von Aminosäuren weiter modifiziert wird, was zur Entstehung von Proinsulin führt, das aus zwei Ketten A und B besteht, die durch das C-Peptid verbunden sind. Anschließend wird das C-Peptid von Proinsulin abgespalten, was zur endgültigen Form führt. Sobald Glukose im Körper auftaucht, erhält die Bauchspeicheldrüse das Signal, Granula mit gespeicherter Insulin- und C-Peptid-Molekülen freizusetzen. Die biologische Rolle von Aminosäuren, Proteinen und Peptiden liegt in der richtigen Funktion und Regeneration des Körpers. Das C-Peptid verbleibt in der Leber deutlich länger als Insulin, da es dort nicht abgebaut wird. Sein Abbau erfolgt hauptsächlich in den Nieren. Sowohl bei Insulin als auch bei C-Peptid führen erhöhte oder zu niedrige Konzentrationen zur Entwicklung von Typ-I- oder Typ-II-Diabetes sowie zum Cushing-Syndrom. Bei C-Peptid können Schwankungen der Konzentration auch auf chronische Niereninsuffizienz oder das Vorhandensein von Metastasen oder lokaler Tumorrezidive hinweisen, weshalb es so wichtig ist, die normalen Konzentrationswerte aufrechtzuerhalten.
Motilin
Motilin ist ein Hormon, das mit der glatten Muskulatur von Magen und Darm verbunden ist und durch Fasern des Vagusnervs kontrolliert wird. Es wird in endokrinen Zellen synthetisiert. Als Peptidhormon, das aus 22 Aminosäuren in einer spezifischen Sequenz besteht, wird es von Zellen des Dünndarms produziert. Es wird von den endokrinen Zellen des Magen-Darm-Systems (M-Zellen) gebildet und ist an der Regulation der Motilität des Verdauungstrakts beteiligt. Motilin ist ein wichtiges Hormon, das an der Entstehung der dritten Phase des wandernden motorischen Komplexes (MMC) beteiligt ist, in der Magen und Dünndarm die Aufgabe haben, den Magen von unnötigen Nahrungsresten und abgestoßenen Epithelzellen zu entleeren, indem es peristaltische Bewegungen anregt. Das Hormon beeinflusst außerdem die Entleerung der Gallenblase während der Verdauungspausen, wenn die Motilin-Konzentration am höchsten ist.
Glukagon
Glukagon ist eines der Hormone, die an der Regulierung des Glukosespiegels beteiligt sind. Dieses Peptid wird von den endokrinen Zellen der Bauchspeicheldrüse ausgeschüttet. Es ist ein Polypeptid, das aus 29 Aminosäuren besteht und aus einem Vorläufer mit 180 Aminosäuren gebildet wird. Veränderungen des Glukosespiegels ermöglichen die Ausschüttung von Glukagon. Die Produktion des Hormons Glukagon erfolgt in den Langerhans-Inseln der Bauchspeicheldrüse, wo aus Proglukagon sowohl Glukagon als auch das glukoseabhängige insulinotrope Polypeptid (GRPP) entstehen. Die Hauptaufgabe von Glukagon besteht darin, den normalen Glukosespiegel im Serum aufrechtzuerhalten, insbesondere bei einem Abfall zwischen den Mahlzeiten oder bei körperlicher Anstrengung. In solchen Situationen werden seine Vorräte aus der Leber freigesetzt, um den Körper angemessen zu schützen. Zusätzlich kann es an der Regulation während der Nahrungsaufnahme beteiligt sein, wodurch das Sättigungsgefühl früher eintreten kann. Glukagon kann potenziell die Freisetzung von Ghrelin hemmen und auch die Darmperistaltik unterdrücken. Die biologische Rolle von Aminosäuren, Proteinen und Peptiden bei der richtigen Funktion und Regeneration des Körpers
Proteinhormone
Wachstumshormon HGH Das Wachstumshormon HGH wird auch Somatotropin genannt. Es wird von den azidophilen Zellen des Vorderlappens der Hypophyse produziert. Das Hormon führt zu einer erhöhten Proliferation von Zellen verschiedener Gewebe, was zu einer Vermehrung und Vergrößerung dieser Zellen führt. HGH besteht aus 190 Aminosäuren in Form einer einfachen Polypeptidkette. Im Körper wird es pulsartig etwa alle 3-4 Stunden freigesetzt, wobei die höchsten Konzentrationen nachts gemessen werden. Die Hormonfreisetzung wird durch hypothalamische Hormone mit entgegengesetzter Wirkung reguliert. Zu diesen Hormonen gehören das Wachstumshormon-freisetzende Hormon GN-RH und das seine Freisetzung hemmende Hormon SRIF. Während der Freisetzung von Somatotropin wird dieser Prozess durch Neurohormone reguliert: Somatoliberin (GHRH), Somatostatin (GHIH), Ghrelin, Glukokortikosteroide, Fettsäuren, Glukose, Insulin und Sexualhormone. Das Wachstumshormon reguliert Stoffwechselprozesse, das Wachstum des Körpers, die Stimulation und Proliferation von Zellen. Die Wirkung von HGH ist recht breit gefächert und umfasst u.a. die Anregung des Wachstums langer Knochen, die Synthese von Nukleinsäuren und die Regulierung des Kohlenhydratstoffwechsels. Das Wachstumshormon findet breite Anwendung bei Sportlern. Die Verabreichung von Somatotropin bei Sportlern führt zur Stärkung, zum Muskelaufbau und zur Minimierung von Verletzungen während des Trainings durch den Ausbau des Bindegewebes, das Knorpel bildet. Bei der Entscheidung zur Einnahme von Wachstumshormon ist es wichtig, auch andere Faktoren wie ausreichenden Schlaf und eine angemessene Ernährung zu berücksichtigen. Die biologische Rolle von Aminosäuren, Proteinen und Peptiden bei der ordnungsgemäßen Funktion und Regeneration des Körpers
Schlussfolgerungen
Wie oben erwähnt, sind Aminosäuren, Proteine und Peptide an der ordnungsgemäßen Funktion des Körpers beteiligt. Im Fall von Peptiden kann man schließen, dass deren geschickte Anwendung eine sichere, wirksame und zufriedenstellende Gesundheitsbehandlung ermöglicht. Angesichts ihrer Wirkung sind sie für die Anwendung in fast allen Fällen und für alle Personen empfohlen. Besonders empfohlen werden sie Sportlern zu regenerativen und präventiven Zwecken. Mangel sowohl an Protein- als auch an Peptidhormonen kann zu schweren Funktionsstörungen des Körpers führen. Die biologische Rolle von Aminosäuren, Proteinen und Peptiden bei der ordnungsgemäßen Funktion und Regeneration des Körpers.
Bibliographie:
- Bańkowski.E, Biochemie. 2020; 160(1-3):33-41
- Dryweń.M, Dźwigała J, Die Bedeutung der verzweigten Aminosäuren in der menschlichen Ernährung sowie in der Prävention und im Verlauf bestimmter Krankheiten. Allgemeinmedizin und Gesundheitswissenschaften; 2013; 3(1) 379-384
- Darewicz.M, Borawska J, Minkiewicz P, Biologisch aktive Peptide, die aus Nahrungsproteinen freigesetzt werden. 2015; 3(100) 26-41; DOI:10.15193/zntj/2015/100/037
- Miyamoto.T, Nachweis und Quantifizierung von d-Aminosäureresten in Peptiden und Proteinen mittels Säurehydrolyse. 2018; 775-782; DOI:10.1016/j.bbapap.2017.12.010
- Bottecchia.C, Photokatalytische Modifikation von Aminosäuren, Peptiden und Proteinen. 2018; 26-42; DOI:10.1002/chem.201803074
- Rutherfurd M, Aminosäureanalyse. 2009; 11.9.1-11.9.37; DOI:10.1002/0471140864.ps1109s58
- Rob.M, Liskamp.J, Peptide und Proteine als weiterhin spannende Inspirationsquelle für Peptidomimetika. 2011; 1626-1653; DOI:10.1002/cbic.201000717
- Lewandowski K, Lewiński A, Peptidhormone, die im Verdauungstrakt ausgeschieden werden. 2012: 12(1) 10-14
- Klein A. Molekulare Mechanismen der hormonellen Regulation. Verlag der Jagiellonen-Universität. 2010; 200-233
- Marciniak. P, Szymczak.M, Peptidhormone. Fortschritte der Zellbiologie. 2011; 43-63
- O’Neill.R, Murphy.R, Endokrinologie. 2012; 30-45
- Siewko.K, Szelachowska.M, C-Peptid als Risikofaktor für die Entwicklung von Typ-1-Diabetes bei Verwandten ersten Grades von Patienten mit autoimmunem Diabetes. P2009; 60(5) 26-43
- Romański.K, Goździewska.K, Ghrelin und Motilin – Ähnlichkeiten und Unterschiede in der Regulation der motorischen Aktivität des Verdauungstrakts. 2008; 64(11) 5-19
- Nylec.M, Olszanecka.M, Die Rolle von Glukagon in der Pathogenese des Typ-II-Diabetes. 2010; 1734-3321
- Hsiao.Y, Yamada.M, Die Rollen von Peptidhormonen und ihren Rezeptoren während der Pflanzenwurzelentwicklung. 2020; 12(1) 22; DOI:10.3390/genes12010022
- Imura.H, Nakai Y, Tanaka N, ACTH und verwandte Peptide. 2000; 41(5) 949-56
- Brownstein M, Adrenocorticotropes Hormon im zentralen Nervensystem. 2000; 22: 93-9
- Itoh. A, Motilin und klinische Anwendung. 2001; 593-608; DOI:10.1016/S0196-9781(96)00333-6 19. Chen.C, Ghrelin und Motilin im Magen-Darm-System. 2012; DOI:10.2174/138161212803216915
- Drucker.D, Wirkmechanismen und therapeutische Anwendung von Glukagon-ähnlichem Peptid-1. Zellstoffwechsel, 2018: 740-756; DOI:10.1016/j.cmet.2018.03.001
- Bildingmaier. M, Wachstumshormon. 2009; 187-200
- Lee.S, Park.H, Bewertung der Bioeffizienz einer stabilisierten Form des menschlichen Wachstumshormons (SP-hGH). 2013; 45(10):722 -727; DOI:10.1055/s-0033-1345126
- Maciejewska.Z, Korek.E, Die Rolle des Wachstumshormons, des insulinähnlichen Wachstumsfaktors Typ 1 und von Ghrelin. 2016; 216-220





BPC-157 Produkt des Jahres 2020! Neuerungsreichtum an erster Stelle!
Neuroprotektive und stimmungsaufhellende Wirkung von BPC-157. Einfluss von BPC-157 auf die Gehirnfunktion.