Peptides
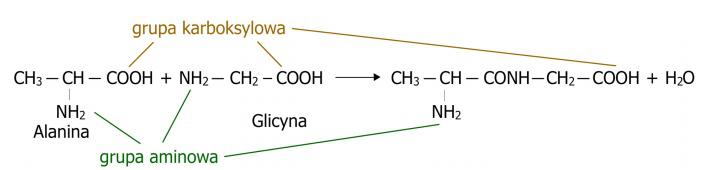
Les peptides sont des composés chimiques construits de manière similaire aux protéines, à partir d'acides aminés. Ils se forment par la combinaison de deux acides aminés ou plus par le biais d'une liaison peptidique à la suite d'un processus de condensation, où, en plus du peptide, une molécule d'eau est également produite. (Fig.1) Ils suscitent un large intérêt, remplissant des fonctions biologiques importantes. De nombreuses hormones ainsi que des neurotransmetteurs sont en fait des peptides. Dans le cas des peptides endogènes, ils agissent de manière antimicrobienne, servant de système de défense pour l'organisme. Les peptides naturellement présents et leurs analogues synthétiques sont considérés comme des composés attrayants d'importance thérapeutique en raison de leur haut degré d'activité, de leur faible toxicité et de l'absence d'interactions avec les médicaments. Dans la pratique médicale, seuls quelques peptides sont utilisés en raison de leur instabilité biologique et de leur dégradation rapide, cependant, la synthèse de peptides permet d'obtenir des formes stables. Il en va de même, par exemple, dans le cas de la synthèse de peptides à partir de sources naturelles. Les peptides se présentent sous une forme non ramifiée, possédant uniquement deux extrémités spécifiques. L'une d'elles est appelée l'extrémité aminée, où se trouve un acide aminé avec un groupe α-aminé libre. L'autre est appelée l'extrémité carboxylique ou l'extrémité C, où se trouve un acide aminé avec un groupe α-carboxylique libre.
Figure 1. Représentation du processus de condensation, c'est-à-dire du processus de formation du peptide
Nomenclature des peptides
La nomenclature des peptides commence par le nom du résidu d'acide aminé N-terminal, puis les noms des résidus d'acides aminés suivants sont énumérés et se termine par le nom de l'acide aminé C-terminal. L'ordre des acides aminés est noté à l'aide de symboles à trois lettres ou à une lettre.
Liaison peptidique
Le carbone, à la suite de la réaction du groupe α-carboxyle, se lie à l'azote du groupe α-amino par une liaison simple, la liaison peptidique. On suppose que cette liaison se forme sous la forme de deux structures qui restent en équilibre mutuel. La liaison C-N se transforme en C=N et vice versa. La rotation autour de l'axe C=N n'est pas possible, ce qui rend la liaison peptidique suffisamment rigide pour posséder des caractéristiques de liaison double. Dans le cas de la liaison peptidique impliquant le groupe imine de la proline ou de l'hydroxyproline avec le groupe carboxyle d'un autre acide aminé, une autre structure distincte se forme. L'azote, dans ce cas, est intégré dans la structure du cycle pyrrolidine, sans substituant hydrogène, ce qui empêche la rotation par rapport aux liaisons qui se forment en présence de l'azote. Les acides aminés participant à la formation de la liaison peptidique perdent des fragments de molécules. Ce sont les molécules -OH du groupe carboxyle et -H du groupe aminé. C'est pourquoi les acides aminés présents dans les peptides et les protéines sont appelés résidus d'acides aminés. Les liaisons peptidiques formées sont durables et leur rupture ne peut se produire qu'en présence de fortes bases et d'acides à une température élevée. La manière dont la liaison peptidique se forme est présentée dans le schéma. (Fig. 2)
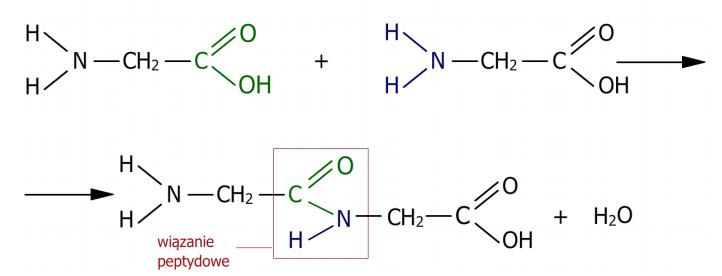
Figure 2. Schéma de formation de la liaison peptidique
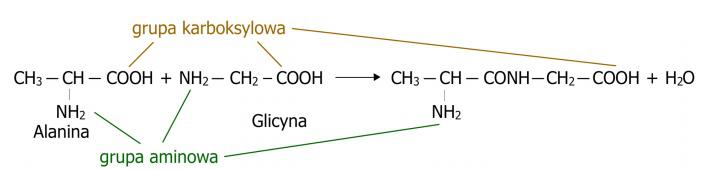
Rupture de la liaison peptidiqueLa rupture de la liaison peptidique se produit à la suite de la réaction d'hydrolyse du peptide, qui repose sur la rupture des liaisons peptidiques formées et la reconstitution des acides aminés individuels. Cette réaction implique de l'eau, dont les molécules se décomposent en groupes hydroxyles (-OH) et atomes d'hydrogène (H), puis se combinent avec les liaisons libérées de la substance. Le schéma de la réaction d'hydrolyse du peptide est présenté dans le schéma. (Fig.3)
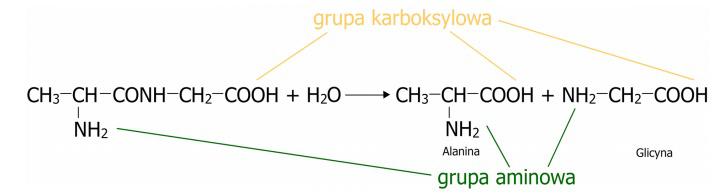
Figure 3. Processus d'hydrolyse entraînant la rupture de la liaison peptidique
Classification des peptidesLes classifications des peptides sont établies en fonction du nombre d'acides aminés dont ils sont constitués. Dans la classification générale des peptides, nous distinguons :
-
Dipeptides - produits résultant de la réaction de deux acides aminés tout en conservant le groupe amine libre de l'un des acides aminés et le groupe carboxyle libre de l'autre acide aminé ;
-
Oligopeptides - peptides composés de quelques à plusieurs dizaines d'acides aminés ;
-
Polypeptides - peptides plus longs, contenant plusieurs dizaines de résidus d'acides aminés ;
-
Protéines – on considère qu'une molécule est une protéine lorsqu'elle est composée de plus de cent résidus d'acides aminés.
Les formules des peptides sont établies sur la base d'un tableau contenant les formules des acides aminés protéiques ainsi que leurs abréviations (Tab.1)
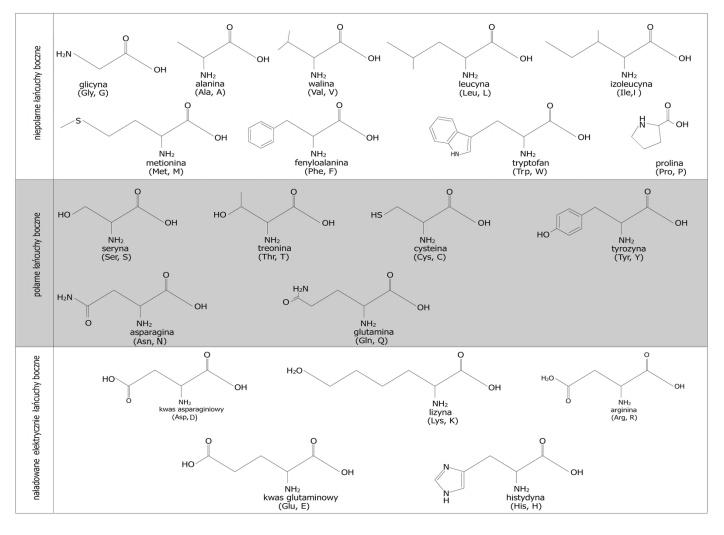
Tableau 1. Formules des acides aminés utilisées pour la nomenclature des peptides
Spectre d'activité des peptidesLes peptides montrent un large spectre d'activité biologique et sont utilisés dans le traitement des infections bactériennes, des maladies virales, des maladies cardiovasculaires, du système osseux, du système nerveux, du diabète ou de l'ostéoporose.
Avantages des peptides- Haute activité et sélectivité
- Large éventail d'objectifs moléculaires
- Toxicité potentiellement inférieure par rapport aux composés de faible poids moléculaire
- Faible accumulation dans les tissus
- Haute diversité chimique et biologique
- Possibles à découvrir au niveau des gènes
- Synthèse facile des analogues
Synthèse des peptides
Selon le peptide que nous souhaitons obtenir, nous avons besoin de la méthode appropriée pour sa synthèse. Dans une brève explication, nous allons essayer de présenter la synthèse des peptides en fonction de leur taille. Pour obtenir un dipeptide, il faut utiliser un réactif qui activera le groupe carboxyle de l'acide aminé arylant ou effectuer l'acylation d'un acide aminé dans un anhydride. Le processus est laborieux et plus difficile dans le cas de peptides plus grands, que nous obtenons à partir du dipeptide, où il y a élimination de la protection du groupe amine de l'acide aminé N-terminal et acylation avec un autre acide aminé N-protégé. Ce processus est particulièrement long, car les actions mentionnées se répètent jusqu'à ce que le peptide avec la séquence prévue soit obtenu. Dans le cas de l'obtention de grands peptides, la méthode la plus efficace et la plus simple est la méthode de Merrifield. Cette méthode est réalisée à l'étape de phase solide. L'acide aminé C-terminal est fixé à un polymère, puis un autre acide aminé est ajouté, jusqu'à ce que la longueur de chaîne souhaitée soit atteinte.
Peptides biologiquement actifsLes hormones peptidiques et les hormones protéiques se trouvent couramment dans notre environnement. Auparavant connues principalement comme des formes peu stables. Sous l'effet de la synthèse, il est de plus en plus possible de choisir une thérapie peptidique qui sera durable et efficace en fonction des besoins de l'organisme. C'est pourquoi il est important de jouer habilement et en toute sécurité avec la stimulation des hormones. En tenant compte de certains peptides, qui sont biologiquement actifs, nous pouvons citer le glutathion, qui étant un tripeptide à structure spécifique est composé de glutamate, cystéine et glycine. Le glutamate se présente comme un acide aminé N-terminal. La combinaison du glutamate avec la cystéine est cependant atypique pour les peptides et les protéines, car il n'y a pas de groupe α-carboxyle du glutamate, mais un groupe γ-carboxyle. Le glutathion se présente donc sous forme réduite et oxydée, étant γ-glutamylcystéinyglycine. Sous forme réduite, il possède un groupe sulfhydryle libre et sous forme oxydée, il y a séparation d'une paire d'atomes d'hydrogène des groupes –SH. Les atomes de soufre restent dépourvus d'hydrogène, ce qui entraîne la formation d'un pont disulfure. Les capacités modifiantes du glutathion en état oxydé ou réduit sont essentielles dans les processus d'oxydoréduction.
Un exemple est également l'ocytocine et la vasopressine, qui étant des nanopeptides, produits par les neurones de l'hypothalamus, libérés par le lobe postérieur de l'hypophyse, ne diffèrent que par deux acides aminés. La cystéine se trouve en deux positions, conduisant ainsi à la formation d'un pont disulfure. L'ocytocine agit comme une hormone stimulant les contractions de l'utérus. La vasopressine, quant à elle, stimule la réabsorption de l'eau dans les tubules rénaux. La vasopressine joue également un rôle essentiel dans la régulation de la sécrétion de l'hormone adrénocorticotrope (ACTH) en cas de situations stressantes.
Hormones peptidiques
L'hormone adrénocorticotrope (ACTH)
L'hormone adrénocorticotrope, en tant que peptide de 39 acides aminés, est produite à la suite de la dégradation d'une molécule précurseur beaucoup plus grande, la pro-opiomélanocortine (POMC). La pro-opiomélanocortine se présente également comme une source d'autres peptides actifs. Deux peptides sont contenus dans la structure de l'ACTH. Il s'agit de l'hormone α-mélanotropique (α-MSH), qui est identique dans sa structure aux 13 premiers acides aminés de l'ACTH, et d'un peptide de la partie intermédiaire de l'hypophyse similaire à la corticotropine - le fragment 18-39 de l'ACTH. La fonction principale de l'ACTH est considérée comme étant la stimulation du cortex surrénalien de manière à ce qu'il soit capable de sécréter des hormones stéroïdiennes. L'hormone adrénocorticotrope est responsable de la régulation des fonctions au niveau des couches fasciculée et réticulée. Les 18 premiers acides aminés sont responsables de l'activité biologique de l'ACTH. La régulation de l'ACTH se fait par la corticolibérine (CRH), une hormone présente dans l'hypothalamus, qui libère la corticotropine par le cortisol via un rétrocontrôle négatif. Cela signifie qu'un déficit en cortisol stimule la CRH et l'ACTH, tandis que son excès inhibe cette sécrétion. Ainsi, en libérant du cortisol, cela régule de nombreuses fonctions vitales essentielles, notamment la mobilisation de l'organisme dans des conditions de stress, l'augmentation de la pression artérielle ou les capacités anti-inflammatoires. Sécrété de manière pulsatile selon un rythme diurne, l'ACTH signifie que sa concentration est la plus élevée le matin, lorsque cela est le plus souhaitable, puis diminue au fil de la journée. Une augmentation de la sécrétion d'ACTH est observée dans des cas pathologiques tels que l'insuffisance surrénalienne, la maladie de Cushing ou le syndrome de Nelson.
L'insuline et le peptide C
L'insuline et le peptide C sont sécrétés dans le pancréas par l'organisme humain en permanence. Lors de la production d'insuline, dans le processus de sa biosynthèse, le peptide C est produit. Les cellules pancréatiques produisent au premier stade la proinsuline, qui subit une modification supplémentaire par le détachement des acides aminés, ce qui conduit à la formation de proinsuline composée de deux chaînes A et B, qui sont reliées par le peptide C. Ensuite, il y a détachement du peptide C de la proinsuline, ce qui entraîne la formation de la forme finale. Au moment où le glucose apparaît dans l'organisme, le pancréas reçoit un signal pour libérer les granules contenant la molécule d'insuline et le peptide C. Le peptide C est maintenu dans le foie beaucoup plus longtemps que l'insuline, car il n'y est pas dégradé. Sa dégradation se produit principalement dans les reins. En ce qui concerne l'insuline et le peptide C, une concentration élevée ou trop basse conduit au développement du diabète de type I ou II ainsi qu'à la maladie de Cushing. Pour le peptide C, les fluctuations de concentration peuvent également indiquer une insuffisance rénale chronique ou la présence de métastases ou de récidives locales de tumeur, c'est pourquoi il est si important de maintenir des normes correctes de leur concentration.
Motiline
La motiline est une hormone liée aux muscles lisses de l'estomac et des intestins, contrôlée par les fibres du nerf vague. Synthétisée dans les cellules endocrines. En tant qu'hormone peptidique, qui est composée de 22 acides aminés localisés dans une séquence spécifique, elle est produite par les cellules de l'intestin grêle. Produite par les cellules endocrines du système digestif M (Mo), elle participe à la régulation de la motricité du tube digestif. La motiline est une hormone essentielle participant à la formation de la phase III du complexe moteur migrateur (CMM), dans laquelle l'estomac et l'intestin grêle ont pour tâche de vider l'estomac des résidus alimentaires inutiles et des cellules épithéliales exfoliées, en stimulant les mouvements péristaltiques. L'hormone influence également le vidage de la vésicule biliaire pendant la période inter-digestive à la concentration maximale de motiline.
Glucagon
Le glucagon est l'une des hormones impliquées dans la régulation de la concentration de glucose, ce peptide est sécrété par les cellules endocrines du pancréas. C'est un polypeptide composé de 29 acides aminés, dérivé d'un précurseur de 180 acides aminés. Les variations de la concentration de glucose permettent la sécrétion de glucagon. La production de l'hormone qu'est le glucagon se produit dans les îlots pancréatiques, où le glucagon est formé à partir de proglucagon ainsi que du polypeptide pancréatique dépendant de la glicentine (GRPP). La principale fonction du glucagon est de maintenir une concentration normale de glucose dans le sérum, lors de sa baisse entre les repas ou lors d'un effort physique. Ses réserves dans de telles situations sont libérées par le foie pour assurer une protection adéquate à l'organisme. De plus, il peut participer à la régulation lors de l'ingestion de nourriture, ce qui peut entraîner une sensation de satiété plus précoce. Le glucagon peut potentiellement inhiber la libération de ghréline et également inhiber la péristaltisme intestinal.
Analogues de peptidesLes analogues de peptides sont des composés chimiques appropriés grâce auxquels un atome est remplacé par un autre par rapport au composé de départ. La structure générale du peptide reste inchangée. Les analogues peptidiques comprennent des analogues en structure hélicoïdale ainsi que des analogues en β-coudes et en β-feuilles. Dans le premier, les hélices sont l'un des éléments structurels clés des peptides bioactifs. La stabilisation de courts fragments d'oligomères dans une conformation hélicoïdale entraîne une augmentation de l'activité. Dans les analogues en β-coudes et en β-feuilles, il y a insertion de résidus d'acides aminés D ou d'acides aminés β,γ,δ. Les analogues peptidiques nous permettent d'obtenir de nouveaux composés peptidiques qui seront plus stables, trouveront une application dans un spectre symptomatique plus large et permettront des solutions innovantes aux problèmes liés à l'action des formes précédentes avant les analogues.
Salage des peptidesLe processus de salage consiste à changer les charges protéiques. Les charges de la protéine sont neutralisées par des anions et des cations de sels. Les molécules de protéine ne s'attirent pas et ne forment pas d'agrégats, et la protéine elle-même est précipitée en raison de la perte de son manteau hydrique. Le processus de salage est un processus réversible. Dans le processus inverse, le sel est éliminé par dialyse ou sa concentration est réduite par l'ajout d'eau. Sur la base de nos articles précédents, on peut affirmer sans hésitation que le salage, qui a conduit à la formation d'une forme stable du peptide BPC-157, est une méthode innovante pour assurer la stabilité peptidique et, par conséquent, élargir l'action biologique des peptides.
Acétylation des peptidesL'acétylation consiste à l'ajout de radicaux acétyles aux substrats, qui sont des composés avec un groupe NH2, OH ou SH, avec l'aide de l'enzyme N-acétyltransférase. La source du radical acétyle est l'acétyl-CoA. La fonction principale des N-acétyltransférases est de faciliter la liaison du groupe acétyle avec le groupe aminé des amines aromatiques et des hydrazines (réaction d'acétylation), c'est-à-dire la détoxification de composés exogènes potentiellement toxiques.
Amidation des peptidesAu moment où les liaisons peptidiques se rompent et par conséquent où la chaîne polypeptidique se fragmente, des groupes carbonyles se forment. L'oxydation de la molécule de protéine par le radical hydroxyle commence par le détachement d'un atome d'hydrogène au niveau du carbone α de l'acide aminé. Le radical alkyle formé réagit avec l'oxygène pour créer un radical alkylperoxyde qui se transforme en alkylhydroperoxyde. Le radical alkoxyle qui en résulte peut se transformer en résidu d'acide aminé hydroxylé au niveau du carbone α ou peut conduire à la fragmentation de la chaîne polypeptidique. La présence du radical alkoxyle favorise la fragmentation de la chaîne polypeptidique. La rupture de la liaison peptidique peut se produire par α-amidation ou diamidation. Le peptide N-terminal formé lors de la fragmentation α-amidique a un groupe amide à l'extrémité C, tandis que l'autre peptide contient à l'extrémité N un dérivé N-α-cétoacyle. La fragmentation par voie diamidique se caractérise par la formation d'un peptide N-terminal contenant une structure diamide et d'un peptide provenant de l'extrémité C de la molécule de protéine contenant à l'extrémité N une structure isocyanate.
Bibliographie 1.Murray R. K., Granner D. K., Mayes P. A., Rodwell V, Biochimie de Harper. 1995; Éditions médicales PZWL 2.Jakubke H. D., Jeschkeit H, Acides aminés peptides protéines. 1982; Éditions scientifiques de l'État 4.Kołodziejczak A, Acides aminés et peptides. 2006




L'impact de la thérapie BPC-157 sur le système immunitaire
Peptides aux propriétés antimicrobiennes et leurs analogues obtenus par modification.