Péptidos
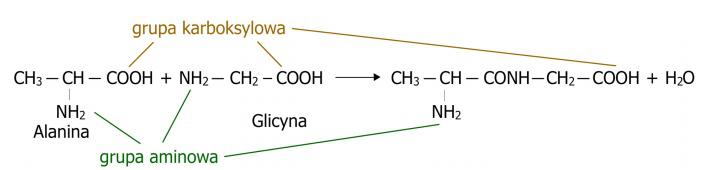
Los péptidos son compuestos químicos construidos de manera similar a las proteínas, a partir de aminoácidos. Se forman mediante la unión de dos o más aminoácidos a través de un enlace peptídico como resultado de un proceso de condensación, donde además del péptido, se genera también una molécula de agua. (Fig.1) Son objeto de amplio interés, desempeñando funciones biológicas importantes. Muchos hormonas y neurotransmisores son precisamente péptidos. En el caso de los péptidos endógenos, actúan contra microorganismos, funcionando como un sistema de defensa del organismo. Los péptidos que se encuentran de forma natural y sus análogos sintéticos son considerados compuestos atractivos con importancia terapéutica debido a su alto grado de actividad, baja toxicidad y ausencia de interacciones con medicamentos. En la práctica médica, solo unos pocos péptidos se utilizan debido a su inestabilidad biológica y rápida degradación, sin embargo, la síntesis de péptidos permite obtener formas estables. De manera similar ocurre, por ejemplo, con la síntesis de péptidos a partir de fuentes naturales. Los péptidos existen en forma lineal, poseyendo solo dos extremos específicos. Uno de ellos se denomina extremo amino, donde se encuentra un aminoácido con un grupo α-amino libre. El otro se llama extremo carboxilo o extremo C, donde se encuentra un aminoácido con un grupo α-carboxilo libre.
Figura 1. Representación del proceso de condensación, es decir, el proceso de formación del péptido
Nomenclatura de péptidos
La nomenclatura de los péptidos comienza con el nombre del residuo del aminoácido N-terminal, luego se enumeran los nombres de los residuos de aminoácidos siguientes y termina con el nombre del aminoácido C-terminal. La secuencia de aminoácidos se escribe usando símbolos de tres letras o de una letra.
Enlace peptídico
El carbono, como resultado de la reacción del grupo α-carboxilo, se une al nitrógeno del grupo α-amino mediante un enlace simple, el enlace peptídico. Se supone que este enlace existe en forma de dos estructuras que permanecen en un equilibrio mutuo definido. El enlace C-N se convierte en C=N y viceversa. La rotación alrededor del eje C=N no es posible, por lo que el enlace peptídico es lo suficientemente rígido como para tener características de un enlace doble. En el caso del enlace peptídico que involucra el grupo imino de la prolina o hidroxiprolina con el grupo carboxilo de otro aminoácido, se forma una estructura diferente y separada. En este caso, el nitrógeno está incorporado en la estructura del anillo de pirrolidina, no hay un sustituyente de hidrógeno, por lo que no hay posibilidad de rotación alrededor de los enlaces que se forman en presencia de nitrógeno. Los aminoácidos que participan en la formación del enlace peptídico pierden fragmentos de moléculas. Son moléculas -OH del grupo carboxilo y -H del grupo amino. Por eso, los aminoácidos que se encuentran en los péptidos y proteínas se llaman residuos de aminoácidos. Los enlaces peptídicos formados son estables y su ruptura solo puede ocurrir bajo la acción de bases y ácidos fuertes a la vez que a alta temperatura. El modo de formación del enlace peptídico se muestra en el esquema. (Fig.2)
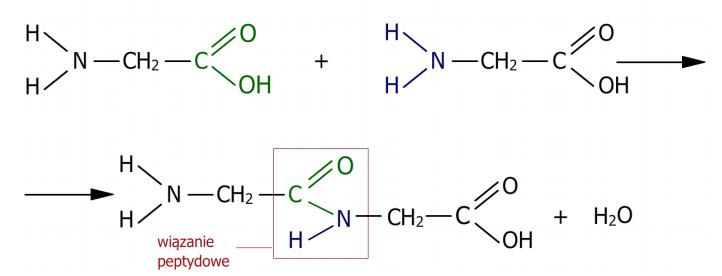
Figura 2. Esquema de formación del enlace peptídico
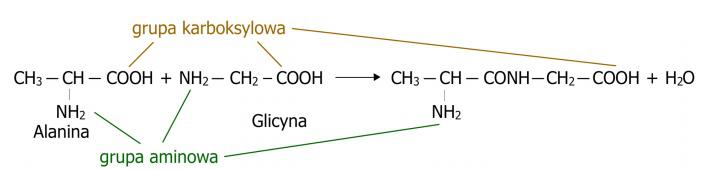
Ruptura del enlace peptídicoLa ruptura del enlace peptídico ocurre como resultado de la reacción de hidrólisis del péptido, que se basa en la ruptura de los enlaces peptídicos formados y la restauración de los aminoácidos individuales. En esta reacción participa agua, cuyas moléculas se descomponen en grupos hidroxilo (-OH) y átomos de hidrógeno (H), que luego se unen a los enlaces liberados de la sustancia. El esquema de la reacción de hidrólisis del péptido se muestra en el esquema. (Fig.3)
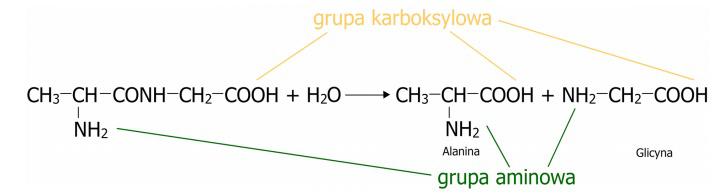
Figura 3. Proceso de hidrólisis que provoca la ruptura del enlace peptídico
Clasificación de péptidosLa clasificación de los péptidos se establece según la cantidad de aminoácidos que los componen. En la clasificación general de péptidos distinguimos:
-
Dipeptidos – productos que se forman por la reacción de dos aminoácidos manteniendo un grupo amino libre de uno de los aminoácidos y un grupo carboxilo libre del otro aminoácido;
-
Oligopéptidos – péptidos compuestos por varios a una docena de aminoácidos;
-
Polipéptidos – péptidos más largos, que contienen varias decenas de residuos de aminoácidos;
-
Proteínas – se consideran cuando la molécula está compuesta por más de cien residuos de aminoácidos.
Las fórmulas de péptidos se crean basándose en una tabla que contiene las fórmulas de aminoácidos proteicos y sus abreviaturas (Tab.1)
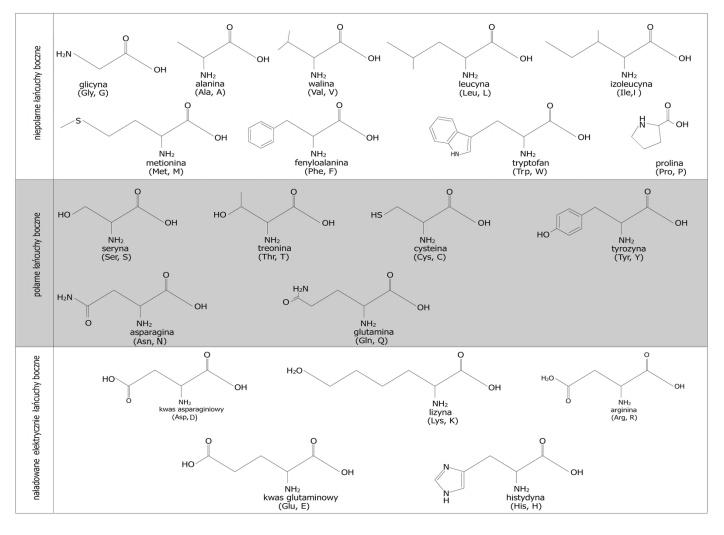
Tabla 1. Fórmulas de aminoácidos utilizadas para la nomenclatura de péptidos
Espectro de actividad de los péptidosLos péptidos muestran un amplio espectro de actividad biológica y se utilizan en el tratamiento de infecciones bacterianas, enfermedades virales, enfermedades del sistema circulatorio, sistema óseo, sistema nervioso, diabetes u osteoporosis.
Ventajas de los péptidos- Alta actividad y selectividad
- Amplio rango de objetivos moleculares
- Potencialmente menor toxicidad en comparación con compuestos de bajo peso molecular
- Baja acumulación en tejidos
- Alta diversidad química y biológica
- Posible de descubrir a nivel genético
- Síntesis fácil de análogos
Síntesis de péptidos
Dependiendo del péptido que queramos obtener, necesitamos el método adecuado para su síntesis. En una breve explicación intentaremos presentar la síntesis de péptidos en relación con su tamaño. Para obtener un dipéptido se debe usar un reactivo que active el grupo carboxilo del aminoácido arilante o convertir el aminoácido acilante en un anhídrido. Un proceso más laborioso y difícil es la síntesis de péptidos más grandes, que se obtienen a partir del dipéptido, donde se elimina la protección del grupo amino del aminoácido N-terminal y se acila con otro aminoácido N-protegido. Este proceso es especialmente laborioso porque estas acciones se repiten hasta obtener el péptido con la secuencia planificada. Para obtener péptidos grandes, el método más efectivo y sencillo es el método de Merrifield. Este método se realiza en fase sólida. El aminoácido C-terminal se fija a un polímero y luego se añade el siguiente aminoácido, hasta alcanzar la longitud deseada de la cadena.
Péptidos biológicamente activosLas hormonas peptídicas y las hormonas proteicas son comunes en el entorno que nos rodea. Anteriormente se conocían en su mayoría como formas poco estables. Bajo la influencia de la síntesis, es cada vez más posible seleccionar terapias peptídicas que sean duraderas y efectivas según las necesidades del organismo. Por eso vale la pena manejar con habilidad y seguridad la estimulación hormonal. Teniendo en cuenta que algunos péptidos son biológicamente activos, podemos citar como ejemplo al glutatión, que siendo un tripéptido con una estructura específica está compuesto por glutamato, cisteína y glicina. El glutamato aparece como aminoácido N-terminal. La unión del glutamato con la cisteína es inusual para péptidos y proteínas, ya que aquí no está presente el grupo α-carboxilo del glutamato, sino el grupo γ-carboxilo. Por lo tanto, el glutatión existe en forma reducida y oxidada, siendo γ-glutamilcisteinilglicina. En su forma reducida posee un grupo sulfhidrilo libre y en la forma oxidada se produce la pérdida de un par de átomos de hidrógeno de los grupos –SH. Los átomos de azufre quedan sin hidrógeno, lo que resulta en la formación de un puente disulfuro. La capacidad modificadora del glutatión en estado oxidado o reducido es importante en los procesos redox.
Un ejemplo también son la oxitocina y la vasopresina, que siendo nano-péptidos, producidos por las neuronas del hipotálamo y liberados por el lóbulo posterior de la hipófisis, difieren solo en dos aminoácidos. La cisteína aparece en dos posiciones, lo que conduce a la formación de un puente disulfuro. La oxitocina actúa como una hormona que estimula la actividad contráctil del útero. La vasopresina, por otro lado, estimula la reabsorción de agua en los túbulos renales. La vasopresina también desempeña un papel importante en la regulación de la secreción de la hormona adrenocorticotrópica (ACTH) en situaciones de estrés.
Hormonas peptídicas
Hormona adrenocorticotrópica (ACTH)
La hormona adrenocorticotrópica, como péptido de 39 aminoácidos, se produce por la degradación de una molécula precursora mucho mayor llamada proopiomelanocortina (POMC). La proopiomelanocortina también es fuente de otros péptidos activos. Dos péptidos están contenidos precisamente en la estructura de la ACTH. Estos incluyen la hormona α-melanotropina (α-MSH), que en su estructura es idéntica a los primeros 13 aminoácidos de la ACTH, y el péptido de la parte intermedia de la hipófisis similar a la corticotropina, fragmento 18-39 de la ACTH. La función principal de la ACTH se considera la estimulación de la corteza suprarrenal para que sea capaz de secretar hormonas esteroides. La hormona adrenocorticotrópica es responsable de regular la actividad en el nivel de las capas fasciculada y reticular. La actividad biológica de la ACTH está determinada por los primeros 18 aminoácidos. La regulación de la ACTH se realiza a través de la corticoliberina (CRH), una hormona que se encuentra en el hipotálamo y que libera corticotropina mediante el cortisol a través de un mecanismo de retroalimentación negativa. Esto significa que la deficiencia de cortisol estimula la liberación de CRH y ACTH, mientras que su exceso inhibe esta secreción. Así, al liberar cortisol, se regulan muchas funciones vitales importantes, como la movilización del organismo ante condiciones de estrés, el aumento de la presión arterial y las capacidades antiinflamatorias. La ACTH se secreta de forma pulsátil con un ritmo circadiano, lo que significa que su concentración más alta se observa en las horas de la mañana, cuando es más necesaria, y luego disminuye a lo largo del día. El aumento de la secreción de ACTH se observa en casos patológicos como insuficiencia suprarrenal, enfermedad de Cushing o síndrome de Nelson.
Insulina y péptido C
La insulina y el péptido C son secretados continuamente en el páncreas por el cuerpo humano. Durante la producción de insulina, en el proceso de su biosíntesis, se produce el péptido C. Las células pancreáticas producen en la primera etapa la preproinsulina, que sufre modificaciones posteriores mediante la eliminación de aminoácidos, lo que conduce a la formación de la proinsulina compuesta por dos cadenas, A y B, que están unidas por el péptido C; luego, el péptido C se separa de la proinsulina, lo que da lugar a la forma final. Cuando aparece glucosa en el organismo, el páncreas recibe la señal para liberar gránulos con moléculas almacenadas de insulina y péptido C. El péptido C se mantiene en el hígado mucho más tiempo que la insulina, debido a que no se degrada allí. Su descomposición ocurre principalmente en los riñones. En el caso de la insulina y el péptido C, una concentración elevada o demasiado baja conduce al desarrollo de diabetes tipo I o II, así como a la enfermedad de Cushing. En el caso del péptido C, las fluctuaciones en su concentración también pueden indicar insuficiencia renal crónica o la presencia de metástasis o recurrencia local del tumor, por lo que es muy importante mantener sus niveles dentro de los rangos normales.
Motilina
La motilina es una hormona relacionada con los músculos lisos del estómago e intestinos, controlada por las fibras del nervio vago. Se sintetiza en células endocrinas. Como hormona peptídica, compuesta por 22 aminoácidos ubicados en una secuencia específica, es producida por las células del intestino delgado. Producida por las células endocrinas del sistema digestivo M (Mo), participa en la regulación de la motilidad del tracto gastrointestinal. La motilina es una hormona importante que participa en la generación de la fase III del complejo motor migratorio (MMC), en la cual el estómago y el intestino delgado tienen la tarea de vaciar el estómago de restos alimentarios innecesarios y células epiteliales descamadas, mediante la estimulación de los movimientos peristálticos. Además, la hormona influye en el vaciamiento de la vesícula biliar durante el período interdigestivo, cuando la concentración de motilina es máxima.
Glucagón
El glucagón es una de las hormonas involucradas en la regulación de la concentración de glucosa; este péptido es secretado por las células endocrinas del páncreas. Es un polipéptido compuesto por 29 aminoácidos, derivado de un precursor con una estructura de 180 aminoácidos. Los cambios en la concentración de glucosa permiten la secreción de glucagón. La producción de la hormona glucagón ocurre en los islotes pancreáticos, donde a partir del proglucagón se forman tanto el glucagón como el polipéptido pancreático dependiente de glicentina (GRPP). La principal función del glucagón es mantener la concentración adecuada de glucosa en el suero durante su descenso entre comidas o durante el esfuerzo físico. Sus reservas en tales situaciones se liberan desde el hígado para proporcionar al organismo la protección adecuada. Además, puede participar en la regulación durante la ingesta de alimentos, por lo que la sensación de saciedad puede aparecer antes. El glucagón potencialmente puede inhibir la liberación de grelina y también puede inhibir la motilidad intestinal.
Análogos de péptidosLlamamos análogos de péptidos a los compuestos químicos correspondientes, gracias a los cuales un átomo es reemplazado por otro en relación con el compuesto original. La estructura general del péptido permanece sin cambios. Entre los análogos peptídicos se incluyen análogos con estructura de hélice y análogos de β-giras y β-láminas. En el primero, las hélices son uno de los elementos estructurales clave de los péptidos bioactivos. La estabilización de fragmentos cortos de oligómeros en conformación helicoidal provoca un aumento de la actividad. En los análogos de β-giras y β-láminas se produce la inserción de residuos de aminoácidos D o aminoácidos β, γ, δ. Los análogos peptídicos nos permiten obtener nuevos compuestos peptídicos que serán más estables, encontrarán aplicación en un espectro sintomático más amplio y permitirán soluciones innovadoras a problemas relacionados con la acción de las formas preexistentes de análogos.
Salazón de péptidosEl proceso de salazón consiste en cambiar las cargas de las proteínas. Las cargas de la proteína se neutralizan mediante aniones y cationes de sales. Las moléculas de proteína no se atraen ni forman agregados y la proteína misma se precipita debido a la pérdida de la capa de agua. El proceso de salazón es reversible. En el proceso inverso, la sal se elimina mediante diálisis o se reduce su concentración añadiendo agua. Basándonos en nuestros artículos anteriores, podemos afirmar con confianza que la salazón que condujo a la formación de una forma estable del péptido BPC-157 es un método innovador para garantizar la estabilidad peptídica y, por lo tanto, ampliar la acción biológica de los péptidos.
Acetilación de péptidosLa acetilación consiste en la unión de radicales acetilo a sustratos que son compuestos con grupos NH2, OH o SH con la participación de la enzima N-acetiltransferasa. La fuente del radical acetilo es el acetil-CoA. La función principal de las N-acetiltransferasas es facilitar la unión del grupo acetilo con el grupo amino de aminas aromáticas e hidrazinas (reacción de N-acetilación), es decir, la detoxificación de compuestos exógenos potencialmente tóxicos.
Amidación de péptidosEn el momento en que se rompen los enlaces peptídicos y, como consecuencia, se fragmenta la cadena polipeptídica, se forman grupos carbonilo. La oxidación de la molécula de proteína por el radical hidroxilo comienza con la separación del átomo de hidrógeno en el carbono α del aminoácido. El radical alquilo resultante reacciona con el oxígeno formando un radical peróxido de alquilo que se convierte en un hidroperóxido de alquilo. El radical alcoxi que se forma a partir de este puede transformarse en un residuo aminoácido hidroxilado en el carbono α o puede provocar la fragmentación de la cadena polipeptídica. La presencia del radical alcoxi favorece la fragmentación de la cadena polipeptídica. La escisión del enlace peptídico puede ocurrir por α-amidación o diamidación. Durante la fragmentación α-amídica, el péptido N-terminal resultante tiene un grupo amida en el extremo C, mientras que el otro péptido contiene en el extremo N un derivado N-α-ketoacilo. La fragmentación por la vía diamídica se caracteriza por la formación de un péptido N-terminal que contiene una estructura diamídica y un péptido derivado del extremo C de la molécula de proteína que contiene en el extremo N una estructura de isocianato.
Bibliografía 1.Murray R. K., Granner D. K., Mayes P. A., Rodwell V, Bioquímica de Harper. 1995; Wydawnictwo Lekarskie PZWL 2.Jakubke H. D., Jeschkeit H, Aminoácidos péptidos proteínas. 1982; Państwowe Wydawnictwo Naukowe 4.Kołodziejczak A, Aminoácidos y péptidos. 2006




Influencia de la terapia BPC-157 en el sistema inmunológico
Péptidos con propiedades antimicrobianas y sus análogos obtenidos mediante modificaciones.